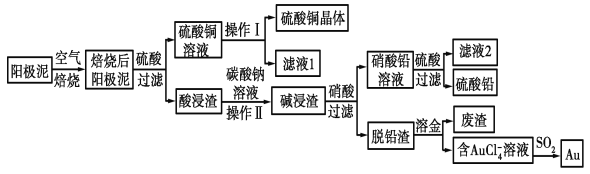
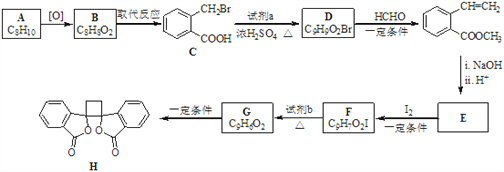
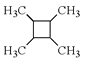
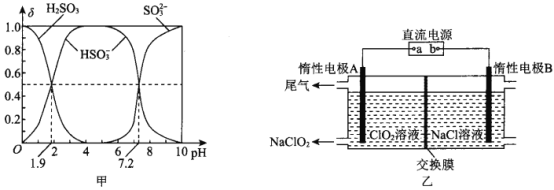
题目内容
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
A. 加催化剂v正、v逆都发生变化,而且变化的倍数相等
B. 加压v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数
D. 加入氩气,v正、v逆都增大且v正增大的倍数大于v逆增大的倍数
【答案】D
【解析】
由反应的热化学方程式N2(g)+3H2(g)![]() 2NH3(g);△H<0可知,反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,平衡向正反应方向移动;正反应放热,则升高温度平衡向逆反应方向移动。
2NH3(g);△H<0可知,反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,平衡向正反应方向移动;正反应放热,则升高温度平衡向逆反应方向移动。
A项、加入催化剂,正逆反应速率都增大,且增大的倍数相同,平衡不移动,故A正确;
B项、反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,v(正)、v(逆)都增大,平衡向正反应方向移动,说明v(正)增大的倍数大于v(逆)增大的倍数,故B正确;
C项、正反应放热,则升高温度平衡向逆反应方向移动,则降低温度,正逆反应速率都减小,平衡向正反应方向移动,v(正)减小的倍数小于v(逆)减小的倍数,故C正确;
D项、在体积不变的密闭容器中通入氩气,虽然压强增大,但参加反应的气体的浓度不变,反应速率不变,平衡不移动,故D错误。
故选D。

 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:

(1)图中未画出的实验器材是________________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
序号 | 反应物 | 起始温度t1/ oC | 终止温度t2/ oC | 中和热 |
① | HCl+NaOH | 14.8 | 18.3 | ΔH1 |
② | HCl+NaOH | 15.1 | 19.7 | ΔH1 |
③ | HCl+NaOH | 15.2 | 18.5 | ΔH1 |
④ | HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①试计算上述两组实验测出的中和热ΔH1=______________。
②某小组同学为探究强酸与弱碱的稀溶液反应时的能量变化,又多做了一组实验④,用0.55mol·L-1的稀氨水代替NaOH溶液,测得温度的变化如表中所列,试计算反应的ΔH2=____________。
③两组实验结果差异的原因是___________________________________________。
④写出HCl+NH3· H2O反应的热化学方程式:_______________________________________。
【题目】一定温度下,在1 L恒容密闭容器中加入1 mol的N2(g)和3 mol H2(g)发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )
2NH3(g) ΔH<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )
时间/min | 0 | t1 | t2 | t3 |
NH3物质的量/mol | 0 | 0.2 | 0.3 | 0.3 |
A. 0~t1 min,v(NH3)=0.2/t1 mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆向移动
C. N2(g)+3H2(g)![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g)![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3 min时再加入1 mol的N2(g)和3 mol H2(g),反应达到新平衡时,c(N2)>0.85 mol·L-1