题目内容
11.下列离子方程式的书写正确的是( )| A. | 0.1 mol•L-1的NaHSO3溶液与0.2 mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| B. | 等浓度的Fe2(SO4)3溶液和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | H218O中投入过氧化钠:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
分析 A.次氯酸钠过量,反应生成次氯酸,次氯酸不能拆开;
B.氢氧化钡不足,离子方程式按照氢氧化钡的组成书写;
C.NaOH少量,碳酸氢根离子部分反应,碳酸根离子不会有剩余;
D.过氧化钠在反应中既是氧化剂也是还原剂,生成的氧气的O原子来自过氧化钠.
解答 解:A.0.1 mol•L-1的NaHSO3溶液与0.2 mol•L-1的NaClO溶液等体积混合,反应生成硫酸根离子和次氯酸,正确的离子方程式为:HSO3-+2ClO-=SO42-+Cl-+HClO,故A错误;
B.等浓度的Fe2(SO4)3溶液和Ba(OH)2溶液混合,反应生成硫酸钡和氢氧化铁,反应的离子方程式为:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓,故B正确;
C.Ca(HCO3)2溶液与少量NaOH溶液反应生成碳酸钙沉淀、碳酸氢钠和水,正确的离子方程式为HCO3-+Ca2++OH-=CaCO3↓+CO32-+H2O,故C错误;
D.H218O中投入过氧化钠,二者反应生成NaOH和氧气,水中的18O存在于氢氧根离子中,正确的离子方程式为:2H218O+2Na2O2=2OH-+218OH-+4Na++O2↑,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,试题侧重考查反应物过量对生成物的影响,D为易错点,需要明确反应中18O生成了氢氧化钠,氧气中的氧原子来自过氧化钠.

练习册系列答案
相关题目
19.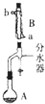 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
CH3COOH+CH3CH2CH2CH2OH?浓硫酸△CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
(1)制备乙酸正丁酯
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下CH3COOH+CH3CH2CH2CH2OH?浓硫酸△CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
6.室温下下列各组离子或分子在指定的溶液中一定能大量共存的是( )
| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
16.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是 ( )
| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
3.关于下列物质的结构或性质分析正确的是( )
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | 甲胺(分子式CH3NH2)的沸点比三甲胺(分子式(CH3)3N)的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 |
20.下列化合物中既有离子键又有共价键的是( )
| A. | KBr | B. | NaOH | C. | HBr | D. | MgCl2 |
1.在恒温下的密闭容器中,有可逆反应:2NO(g)+O2(g)?2NO2(g)(反应放热),能说明已达到平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
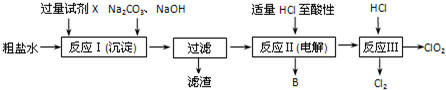
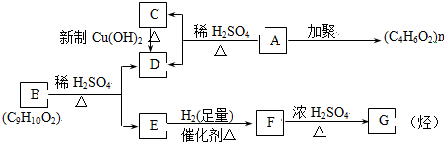
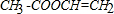 ,B:
,B: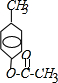 ;
;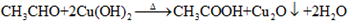 ,
,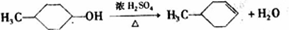 .
.