题目内容
3. 上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.
上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子的核外电子排布式1s22s22p63s23p63d84s2.
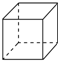
(2)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,如图(正方体)是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置正方体的八个顶点和六个面心.
(3)已知XeO3分子中氙原子上有1对孤电子对,则XeO3为极性(填“极性”或“非极性”)分子.
分析 (1)Ni的原子序数为28,根据能量最低原理和洪特规则书写电子排布式;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,结构不对称.
解答 解:(1)Ni的原子序数为28,根据能量最低原理和洪特规则可写出基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似,
故答案为:正方体的八个顶点和六个面心;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,结构不对称,为极性分子,故答案为:极性;
点评 本题考查较为综合,涉及电子排布式的书写、晶胞结构、分子的极性等知识,题目难度中等,本题注意常见金属的堆积模型,为易错点,也是易忽视的地方.

练习册系列答案
相关题目
14.下列说法中正确的是( )
| A. | 原子晶体中的各相邻原子都以共价键相结合 | |
| B. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
11.已知烯烃在一定条件下氧化时, 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )| A. | 1-己烯 | B. | 2-己烯 | C. | 3-已烯 | D. | 2-甲基-2-戊烯 |
18.下列关于化学反应限度的说法中正确的是( )
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等,都等于0 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
8.下列粒子半径比较中,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
15.一定条件下反应A(s)+3B(g)?2C(g)在10L的密闭容器中进行,测得2min内,A的物质的量由20mol减小到8mol,则下列说法中正确的是( )
| A. | 用反应物A表示该反应的反应速率为0.6 mol•L-1•min-1 | |
| B. | 用反应物B表示该反应的反应速率为1.8 mol•L-1•min-1 | |
| C. | 反应达到平衡时$\frac{2}{3}$v(B)正=v(C)逆 | |
| D. | 升高温度可加快正反应的速率,同时降低逆反应的速率 |
12.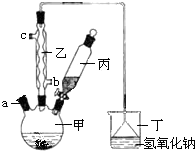 溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
(1)仪器乙的名称为:球型冷凝管;
(2)用如图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应.反应中铁屑的作用是:催化剂;
写出制备溴苯的化学反应方程式是:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(3)丁装置烧杯中倒置的漏斗的目的是:防倒吸;
写出丁中发生的主要化学反应的方程式为:NaOH+HBr=NaBr+H2O;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂A除去,
A 氢氧化钠溶液 B稀盐酸溶液 C氯化钠溶液 D水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作G除去.
E 重结晶 F 过滤 G 蒸馏 H 萃取.
 溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)用如图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应.反应中铁屑的作用是:催化剂;
写出制备溴苯的化学反应方程式是:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(3)丁装置烧杯中倒置的漏斗的目的是:防倒吸;
写出丁中发生的主要化学反应的方程式为:NaOH+HBr=NaBr+H2O;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂A除去,
A 氢氧化钠溶液 B稀盐酸溶液 C氯化钠溶液 D水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作G除去.
E 重结晶 F 过滤 G 蒸馏 H 萃取.
13.已知断裂1mol共价键所需要吸收的能量分别为:H-H:436kJ,I-I:151kJ,H-I:299kJ,下列对H2(g)+I2(g)?2HI(g)的反类型判断错误的是( )
| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
 有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.
有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.