题目内容
20.化合物H是一种香料,存在于金橘中,可用如下路线合成: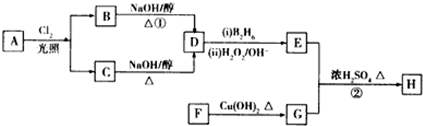
已知:R-CH=CH2$→_{(ii)H_{2}O_{2}/OH-}^{(i)B_{2}H_{6}}$RCH2CH2OH(B2H6为乙硼烷).
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45g H2O.A的分子式是C4H10.
(2)B和C均为一氯代烃,且B分子的核磁共振氢谱图中只有一个吸收峰,则B的名称为2-甲基-2-氯丙烷.(用系统命名法命名)
(3)在催化剂存在下1mol F与2mol H2反应,生成3-苯基-1-丙醇.F的结构简式是
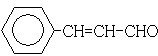 .
.(4)反应①的反应类型是消去反应.
(5)反应②的化学方程式为
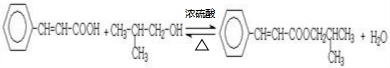 .
.(6)已知K是满足下列条件的G的同分异构体,则K在引发剂作用下生成聚合物的结构简式为
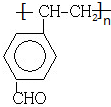 .
.a.属于具有与G相同官能团的芳香类化合物;
b.苯环上有两个取代基,且苯环上的一氯取代物有两种.
分析 88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,B分子的核磁共振氢谱图中只有一个吸收峰,则B为2-甲基-2-氯丙烷,所以C为2-甲基-1-氯丙烷,D发生信息中的反应生成E为 .F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为
.F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为 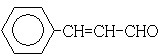 ,F中醛基氧化为羧基生成G为
,F中醛基氧化为羧基生成G为 ,D与E发生酯化反应生成H为
,D与E发生酯化反应生成H为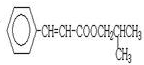 ,据此解答.
,据此解答.
解答 解:88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,B分子的核磁共振氢谱图中只有一个吸收峰,则B为2-甲基-2-氯丙烷,所以C为2-甲基-1-氯丙烷,D发生信息中的反应生成E为 .F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为
.F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为 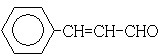 ,F中醛基氧化为羧基生成G为
,F中醛基氧化为羧基生成G为 ,D与E发生酯化反应生成H为
,D与E发生酯化反应生成H为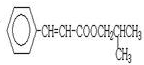 ,
,
(1)根据上面的分析可知,A的学式为C4H10,
故答案为:C4H10;
(2)根据上面的分析可知,B为2-甲基-2-氯丙烷,
故答案为:2-甲基-2-氯丙烷;
(3)F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键.从生成的产物3-苯基-1-丙醇分析,F的结构简式为 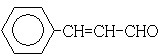 ,故答案为:
,故答案为: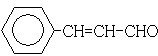 ;
;
(4)反应①为卤代烃在醇溶液中的消去反应,
故答案为:消去反应;
(5)F被新制的Cu(OH)2氧化成羧酸G为 ,D至E为信息相同的条件,则类比可不难得出E的结构为
,D至E为信息相同的条件,则类比可不难得出E的结构为 ,E与G在浓硫酸作用下可以发生酯化反应,反应方程式为:
,E与G在浓硫酸作用下可以发生酯化反应,反应方程式为: ,
,
故答案为: ;
;
(6)K是G的同分异构体,满足下列条件a.属于具有与G相同官能团的芳香类化合物,即有羧基和碳碳双键,b.苯环上有两个取代基,且苯环上的一氯取代物有两种,说明苯环上有两种位置的氢原子,则K为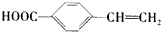 ,K在引发剂作用下生成聚合物的结构简式为
,K在引发剂作用下生成聚合物的结构简式为 ,
,
故答案为: .
.
点评 本题有机物的推断与合成,涉及分子式的判断、反应类型、化学方程式的书写以及同分异构体的判断等,注意把握推断题的关键点和题中重要信息,积累基础知识,以及知识的综合利用.

| A. | 2mol | B. | 2.5 mol | C. | 5 mol | D. | 6 mol |
| A. | 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 | |
| B. | 向0.1mol•L-1Na2CO3溶液中加入少量NaOH固体,c(CO32-)与c(Na+)的增大 | |
| C. | NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下,$\frac{{K}_{W}}{c{(H}^{+})}$=0.1mol•L-1 的溶液中,Na+、K+、CO32-、NO3-、离子可大量共存 |
| A. | 淀粉、纤维素、蛋白质的水解产物相同,都可以用来酿酒 | |
| B. | 油脂水解产物之一的甘油与乙醇含有相同的官能团 | |
| C. | 乙醇与乙醛互为同分异构体,乙醇可由乙烯通过加成反应制取 | |
| D. | 通过石油的裂化可得到乙烯,煤的干馏可得到煤焦油 |
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| C. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| D. | 与稀盐酸反应的剧烈程度:M单质<X单质 |
| A. | ②③⑤ | B. | ①④⑤ | C. | ②③⑥ | D. | ③④⑥ |
| A. | 最高价氧化物对应水化物的碱性:Y>W | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 原子半径:Y<Z | |
| D. | Y最高价氧化物能与W的最高价氧化物的水化物的溶液反应 |
(1)下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化,同主族元素从上至下,电负性逐渐同主族元素从上至下电负性减小.
②预测元素电负性的大小关系:Br>I,
电负性最小的元素在周期表中的位置是第6周期ⅠA族 (放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar.(均填元素符号)