题目内容
11.1mol CH4与Cl2光照下发生充分反应,生成相同物质的量的4种取代物,则消耗的Cl2的物质的量为( )| A. | 2mol | B. | 2.5 mol | C. | 5 mol | D. | 6 mol |
分析 先根据碳原子守恒计算四种有机物的物质的量,然后根据取代反应特点:用1个氯原子取代1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,依据碳、氢原子个数守恒计算消耗氯气的物质的量.
解答 解:1mol CH4与Cl2光照下发生充分反应,生成相同物质的量的4种取代物,所以生成CH3Cl、CH2Cl2、CHCl3、CCl4的物质的量都是0.25mol,因为甲烷与氯气发生取代反是用1个氯原子取代1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,所以CH4与Cl2发生取代反应中消耗的氢原子和氯气分子的个数比是1:1,
所以所需的氯气的物质的量为:0.25mol×1+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,
故选:B.
点评 本题考查的是甲烷和氯气的取代反应,明确取代反应中被取代的氢原子的物质的量与氯气分子的物质的量的关系是解本题的关键,注意原子个数守恒的应用,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
7.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
| A. | 用一定量NaOH稀溶液和稀盐酸反应测得的中和热数据,来推算一定量的稀H2SO4和NaOH稀溶液反应的反应热 | |
| B. | 用沸点数据推测能否用蒸馏的方法将两种液体混合物进行分离 | |
| C. | 用反应热数据的大小判断不同反应的反应速率大小 | |
| D. | 用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱 |
5.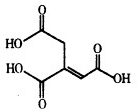 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )| A. | 乌头酸与醋酸是同系物 | |
| B. | 乌头酸中碳元素的质量分数为41.4% | |
| C. | 乌头酸能发生中和反应、水解反应、酯化反应 | |
| D. | 含1mol乌头酸的溶液最多可消耗3mol NaOH、3mol Br2 |
6.下列各组有机物的同分异构体数目相等的是(不考虑立体异构)( )
| A. | C5H12和C4H8 | B. | C4H10和C3H8O | C. | C3H4和C4H9Cl | D. | C3H7Br和C2H6O |
1.下列元素中,不属于主族元素的是( )
| A. | 钡 | B. | 铁 | C. | 钙 | D. | 碘 |
 .其基态原子有26种能量不同的电子;
.其基态原子有26种能量不同的电子;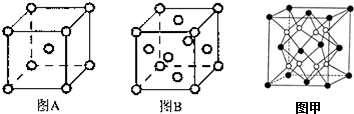
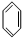 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$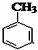 +HBr
+HBr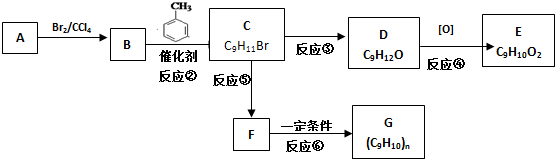
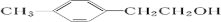 .
.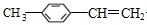 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$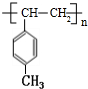
 +
+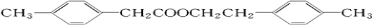
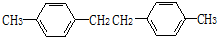 .
.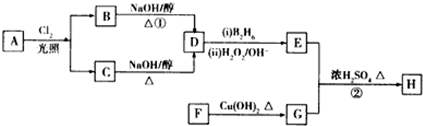
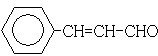 .
.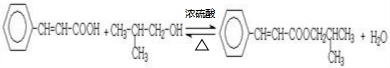 .
.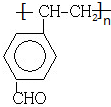 .
.