题目内容
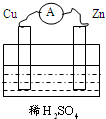 如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )
如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )| A、溶液中的H+向负极移动 |
| B、Zn片作负极,发生还原反应 |
| C、溶液的PH值将增大 |
| D、电子从Cu流出经导线流向Zn |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动.
解答:
解:A、溶液中阳离子向正极移动,阴离子向负极移动,则H+向正极移动,故A错误;
B、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故B错误;
C、该原电池放电时,溶液中氢离子从铜片获得电子被还原成氢气,所以氢离子的浓度减小,则溶液的PH值将增大,故C正确;
D、电子从负极锌片沿导线流向正极铜片,故D错误.
故选C.
B、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故B错误;
C、该原电池放电时,溶液中氢离子从铜片获得电子被还原成氢气,所以氢离子的浓度减小,则溶液的PH值将增大,故C正确;
D、电子从负极锌片沿导线流向正极铜片,故D错误.
故选C.
点评:本题考查了原电池原理,难度不大,注意把握正负极的判断方法,难点是判断溶液中阴阳离子的移动方向.

练习册系列答案
相关题目
已知下列反应:
Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O
2FeCl3+2KI═2FeCl2+I2+2KCl Cl2+2FeCl2═2FeCl3
则下列物质氧化性由强到弱的顺序是( )
Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O
2FeCl3+2KI═2FeCl2+I2+2KCl Cl2+2FeCl2═2FeCl3
则下列物质氧化性由强到弱的顺序是( )
| A、I2>FeCl3>Cl2>Co2O3 |
| B、Co2O3>Cl2>FeCl3>I2 |
| C、Cl2>Co2O3>I2>FeCl3 |
| D、Cl2>I2>Co2O3>FeCl3 |
常温时,下列各组离子在指定溶液中一定不能大量共存的是( )
| A、含有大量NO3-的溶液中:Na+、OH-、I-、SO32- |
| B、pH<7的溶液中:Cu2+、Fe3+、NO3-、Cl- |
| C、使石蕊试液变蓝的溶液中:K+、SO32-、S2-、CO32- |
D、c( )=0.1mol/L的溶液中:Na+、Fe3+、SO42-、NO3- )=0.1mol/L的溶液中:Na+、Fe3+、SO42-、NO3- |
下列有关分子中指定原子的杂化类型正确的是( )
| A、CH4分子中C原子:sp |
| B、BF3中B原子:sp3 |
| C、C2H2中C原子:sp |
| D、SiO2中Si原子:sp2 |
下列离子方程式与所述事实相符且正确的是( )
| A、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | ||||
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| C、向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | ||||
D、以铜为电极电解饱和食盐水:2Cl-+2H2O
|
下列物质既含有共价键又含有离子键的是( )
| A、H2SO4 |
| B、CO2 |
| C、Na2O2 |
| D、CaCl2 |
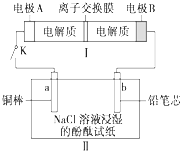 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr
| ||
| 放电 |
| A、负极反应为4Na-4e-═4Na+ |
| B、闭合K后,b电极附近的pH变小 |
| C、闭合K后,a电极上有气体产生 |
| D、当有0.01mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112mL |
下列有关电极和电解质溶液构成的装置叙述不正确的是( )
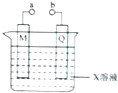

| A、若X、M、Q分别是H2SO4、Pb和PbO2,a、b连接后两极都有PbSO4生成 |
| B、若X、M、Q分别是CuSO4、Ag和Fe无论a、b是否连接Fe都被腐蚀 |
| C、若X、M、Q分别CuSO4、Cu和Fe,a、b是分别连接电源的正负极,则可对铁镀铜 |
| D、若X、M、Q分别是NaCl、C和Fe,则a、b连接后,M电极上有气体产生 |
对于常温下0.01mol/L的氨水,下列叙述正确的是( )
| A、c(H+)+c(NH4+)=2c(OH-) |
| B、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| C、与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3?H2O)+c(NH3)=0.02mol?L-1 |
| D、与等体积等浓度的盐酸混合后所得溶液c(OH-)+c(NH3?H2O)+c(NH3)=c(H+) |