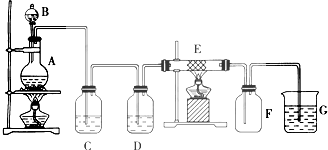
题目内容
5.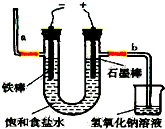 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:(1)若饱和食盐水中含有酚酞,通电后a(填a或b)侧先变红.
(2)电解反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)漂白粉长期露置在空气中失效,请写出相关氧化还原反应的一条化学方程式
2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
分析 (1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气;
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气;
(3)次氯酸不稳定,能发生氧化还原反应.
解答 解:(1)电解饱和食盐水的化学方程式是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,a电极为阴极,阴极上水电解出的氢离子放电,故导致氢离子浓度减小,氢氧根浓度增大,故该电极附近变红,故答案为:a;
(2)电解饱和食盐水的化学方程式是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)次氯酸不稳定,能分解生成氯化氢和氧气,即:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故答案为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查了氯气的工业制法和氯气的性质,氧化还原反应的规律,题目难度中等,解题关键在于明确工业上制备氯气的原理和氯气的性质.

练习册系列答案
相关题目
15.针对如图所示的乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )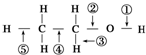
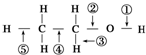
| A. | 与醋酸、浓硫酸共热发生酯化反应时,②键断裂 | |
| B. | 与金属钠反应时,①键断裂 | |
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | |
| D. | 在加热和Ag催化下与O2反应时,①、③键断裂 |
13.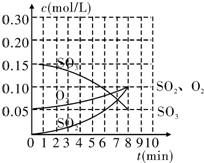 在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
(1)在0~4min内生成O2的平均速率v(O2)=0.0025 mol/(L•min).
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=0.4.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是BD,此时的平衡常数与(2)中相比相等(填“增大”、“减小”或“不变”).
 在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.(1)在0~4min内生成O2的平均速率v(O2)=0.0025 mol/(L•min).
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=0.4.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是BD,此时的平衡常数与(2)中相比相等(填“增大”、“减小”或“不变”).
| 选项 | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
10.下列叙述正确的是( )
| A. | Na202在潮湿的空气中放置一段时间,变成白色贴稠物的原因是2Na202+2CO2=2Na2CO3+O2 | |
| B. | Na202用作呼吸面具中的供氧剂,不涉及氧化还原反应 | |
| C. | 常温常压下,Na202与足量H2O反应生成0.2mol O2时,转移的电子为0.2mol | |
| D. | 将钠放在空气中的变化过程为Na→Na2O→Na0H→Na2CO3•10H2O→Na2CO3 |
17.将4.05g Al投入到1mol/L NaOH溶液中,Al完全反应,至少需要NaOH溶液的体积和生成氢气的体积(标准状况)为( )
| A. | 225mL,5.04L | B. | 150mL,5.04L | C. | 225mL,3.36L | D. | 150mL,3.36L |
13.在2L密闭容器内充入5molA和2.5molB使之发生反应:3A(g)+B(g)?C(g)+2D(g),经过5min反应达到平衡,经测定C的平均反应速率为0.1mol/(L.min).下列叙述中正确的是( )
| A. | 恢复至原温度,容器内压强增大 | B. | A的平均反应速率为0.1mol/(L•min) | ||
| C. | 达到平衡时,B比A的转化率小 | D. | B的平衡浓度为0.25mol/L |
 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)