题目内容
10.下列叙述正确的是( )| A. | Na202在潮湿的空气中放置一段时间,变成白色贴稠物的原因是2Na202+2CO2=2Na2CO3+O2 | |
| B. | Na202用作呼吸面具中的供氧剂,不涉及氧化还原反应 | |
| C. | 常温常压下,Na202与足量H2O反应生成0.2mol O2时,转移的电子为0.2mol | |
| D. | 将钠放在空气中的变化过程为Na→Na2O→Na0H→Na2CO3•10H2O→Na2CO3 |
分析 A.Na202在潮湿的空气中先生成NaOH;
B.Na202与二氧化碳、水反应生成氧气;
C.根据方程式2Na202+2H2O=4NaOH+O2↑分析;
D.Na在常温下与氧气反应生成氧化钠,再与水蒸气反应生成NaOH,NaOH与二氧化碳反应生成碳酸钠晶体,晶体失去结晶水得到Na2CO3.
解答 解:A.Na202在潮湿的空气中先生成NaOH,则Na202在潮湿的空气中放置一段时间,变成白色贴稠物的原因是2Na202+2H2O=4NaOH+O2↑,故A错误;
B.Na202与二氧化碳、水反应生成氧气,反应中过氧化钠中的O元素的化合价发生变化,属于氧化还原反应,故B错误;
C.常温常压下,Na202与足量H2O反应的方程式2Na202+2H2O=4NaOH+O2↑,反应中生成1mol氧气转移2mol电子,则生成0.2mol O2时,转移的电子为0.4mol,故C错误;
D.Na在常温下与氧气反应生成氧化钠,再与水蒸气反应生成NaOH,NaOH与二氧化碳反应生成碳酸钠晶体,晶体失去结晶水得到Na2CO3,则将钠放在空气中的变化过程为Na→Na2O→Na0H→Na2CO3•10H2O→Na2CO3,故D正确.
故选D.
点评 本题考查了钠及其化合物的性质,题目涉及氧化还原反应的判断、电子转移数目的计算、金属化合物的性质等,题目难度不大,注意把握有关物质的性质及转化.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 通信光缆的主要成分是SiO2,太阳能电池的材料主要是晶体Si | |
| B. | K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒 | |
| C. | 由于NaHCO3能与碱反应,所以常用作焙制糕点的膨松剂 | |
| D. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 |
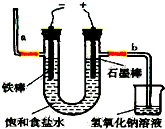 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
 (1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.
(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.