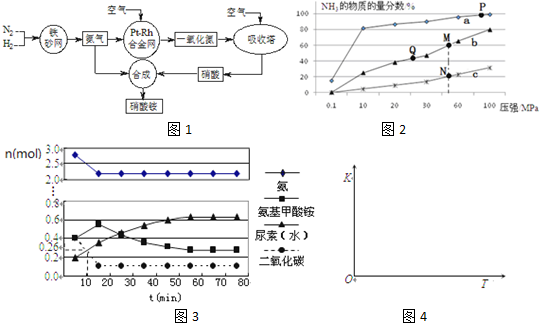
题目内容
14.1942年,我国化学专家侯德榜先生打破国外对制碱技术的垄断,发明了著名的侯氏制碱法,已知:直接从海水中获得的粗盐含有较多的Ca2+、Mg2+,某工业生产纯碱的工艺流程示意图如下:
(1)沉淀A的化学式为Mg(OH)2和CaCO3.
(2)煅烧过程中发生反应的化学反应方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)煅烧是否完全关系到产品的质量,某检验员对煅烧过程中的样品进行检验,其实验方法如下:
首先,称取样品(含有Na2CO3和NaHCO3)4.02g,向其中加入250mL稀HCl,产生CO2的体积为896mL(标准状况下);然后,将过量的HCl用0.2mol/L的NaOH溶液滴定,当消耗NaOH溶液的体积为150mL时,恰好完全中和,计算样品中的Na2CO3的百分含量.
分析 本题利用海水提取氯化钠再利用侯氏制碱原理制纯碱的工业流程,因从海水中获得的粗盐含有较多的Ca2+、Mg2+,加入CaO和Na2CO3除杂时,可生成Mg(OH)2和CaCO3沉淀并经过滤除去,在所得氯化钠溶液里先通氨气再通CO2气体得到碳酸氢钠沉淀,过滤后再锻烧生成纯碱、CO2和水,据此可作答;
(1)从流程分析可知溶液A为Mg(OH)2和CaCO3;
(2)将碳酸氢钠锻烧生成纯碱、CO2和水,结合质量守恒可写出此反应的化学方程式;
(3)样品过量盐酸反应生成CO2是0.896L,其物质的量为$\frac{0.896L}{22.4mol/L}$=0.04mol,根据原子守恒并结合样品的总质量可计算出样品中碳酸钠的质量,再求质量分数.
解答 解:(1)在粗盐的水溶液里加入CaO和Na2CO3后得到的沉淀A为Mg(OH)2和CaCO3,故答案为:Mg(OH)2和CaCO3;
(2)碳酸氢钠受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,故答案为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)样品过量盐酸反应生成CO2物质的量为0.04mol,设碳酸钠的物质的量为xmol,碳酸氢钠为ymol,结合原子守恒可得:①x+y=0.04 ②106x+84y=4.02,解得x=0.03mol,则样品中碳酸钠的质量百分数为$\frac{0.03mol×106g/mol}{4.02g}×100%$=79.1%,答:样品中的Na2CO3的百分含量为79.1%.
点评 本题以侯氏制碱法为载体,探究粗盐提纯的基本操作、碳酸氢钠的热稳定性及样品纯度分析,中等难度,注重基础知识的考查.

| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
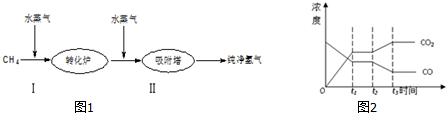
(1)第II步反应为CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,其平衡常数随温度的变化如下:
| 温度T/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)第II步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,向恒容反应器中加入下列物质发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号).
| 实验编号 | n(CO)/mol | n(H2O)/mol | n(H2)/mol | n(CO2)/mol |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
①体系的压强不再变化 ②混合气体的平均相对分子质量不再变化
③体系中各物质的浓度不再改变 ④体系的温度不再变化
⑤混合气体的密度不再变化
(4)图2表示此流程的第II步反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则图中t2时刻发生改变的条件是降低温度或增加水蒸汽的量或减少氢气的量(只写2种).
(5)若400℃时,第Ⅱ步反应生成l molH2放出的热量为 33.2kJ,第Ⅰ步反应的热化学方程式为 CH4(g)+H2O(g)═CO(g)+3H2(g)△H=-103.3kJ•mol-1.
则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-136.5kJ•mol-1.
| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=13,则pH=7 | D. | 若10x=y,且a+b=14,则pH>7 |
 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答: 如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线:
如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线: (1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.
(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.