题目内容
13.在2L密闭容器内充入5molA和2.5molB使之发生反应:3A(g)+B(g)?C(g)+2D(g),经过5min反应达到平衡,经测定C的平均反应速率为0.1mol/(L.min).下列叙述中正确的是( )| A. | 恢复至原温度,容器内压强增大 | B. | A的平均反应速率为0.1mol/(L•min) | ||
| C. | 达到平衡时,B比A的转化率小 | D. | B的平衡浓度为0.25mol/L |
分析 A.平衡时混合气体物质的量减小,容器容积不变,由于反应吸热或放热未知,不能确定温度变化;
B.利用速率之比等于化学计量数之比计算v(A);
C.A、B按物质的量3:1反应,故二者起始物质的量为3:1时,到达平衡时转化率相等,现在A、B物质的量之比为5mol:2.5mol=2:1<3:1,相当于增大B的浓度,与起始物质的量为3:1时相比平衡正向移动,A的转化率增大、B转化率减小;
D.根据△c=v△t计算△c(C),B的平衡浓度=起始浓度-△c(B).
解答 解:A.平衡时混合气体物质的量减小,容器容积不变,由于反应吸热或放热未知,不能确定温度变化,故不能确定压强变化,故A错误;
B.速率之比等于化学计量数之比,则v(A)=3v(C)=0.1mol/(L.min),故B错误;
C.A、B按物质的量3:1反应,故二者起始物质的量为3:1时,到达平衡时转化率相等,现在A、B物质的量之比为5mol:2.5mol=2:1<3:1,相当于增大B的浓度,与起始物质的量为3:1时相比平衡正向移动,A的转化率增大、B转化率减小,则达到平衡时,B比A的转化率小,故C正确;
D.△c(C)=0.1mol/(L.min)×5min=0.5mol/L,由方程式可知△c(B)=△c(C)=0.5mol/L,故B的平衡浓度=$\frac{2.5mol}{2L}$-0.5mol/L=0.75mol/L,故D错误,
故选:C.
点评 本题考查化学平衡计算及影响因素、反应速率计算等,C选项可以计算具体转化率进行判断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),SO2的转化率随温度的变化如表所示:
(1)由表中数据判断?H<0(填“>”、“=”或“<”).
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
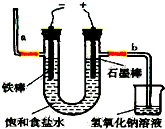 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
 如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线:
如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线: