题目内容
16. 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)试回答下列问题:
(1)试确定150℃时固体物质的化学式K4[Fe(CN)6]
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为避免与醋等酸性物质一起烹饪;控制烹饪温度不超过400℃.
(3)在25℃时,将a mol•L-1的KCN溶液与0.01mol•L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a>0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=(100a-1)×10-7 mol•L-1.
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O═2H2SO4的转化. 已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一个反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.上述转化的重要意义在于以消除SO2的污染,同时制得硫酸,变废为宝 _.
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=1.1×10-3 mol•L-1>1×10-5 mol•L-1,故Fe3+没有沉淀完全.(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全)
分析 (1)42.2g K4[Fe(CN)6]•3H2O的物质的量为0.1mol,含有结晶水质量为0.1mol×3×18g/mol=5.4g,而150℃时固体物质的质量为36.8g,质量减少为42.2g-36.8g=5.4g,故150℃完全失去结晶水;
(2)亚铁氰化钾水溶液与酸反应放出极毒的氰化氢(HCN)气体,加热至一定温度时能分解产生氰化钾(KCN),由图可知应在400℃,故应避免与酸性物质物质一起烹饪、控制烹饪温度不超过400℃;
(3)发生反应:KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性);
HCN?H++CN-的电离平衡常数Ka=$\frac{c({H}^{+})×c(C{N}^{-})}{c(HCN)}$,溶液呈中性,则c(H+)=c(OH-)=10-7 mol/L,由电荷守恒c(H+)+c(K+)=c(CN-)+c(Cl-)+c(OH-),故c(K+)=c(CN-)+c(Cl-),则c(CN-)=(0.5a-0.005)mol/L,根据物料守恒c(HCN)=0.5amol/L-c(CN-)=0.005mol/L,代入电离平衡常数表达式计算;
(4)催化剂的特点,恢复原来状态,则Fe3+→Fe2+,故Fe3+将SO2氧化为硫酸;可以降低SO2的污染,同时制得硫酸;
(5)根据c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$计算判断.
解答 解:(1)42.2g K4[Fe(CN)6]•3H2O的物质的量为0.1mol,含有结晶水质量为0.1mol×3×18g/mol=5.4g,而150℃时固体物质的质量为36.8g,质量减少为42.2g-36.8g=5.4g,故150℃完全失去结晶水,则150℃时固体物质的化学式为:K4[Fe(CN)6],
故答案为:K4[Fe(CN)6];
(2)亚铁氰化钾水溶液与酸反应放出极毒的氰化氢(HCN)气体,加热至一定温度时能分解产生氰化钾(KCN),由图可知应在400℃,故应避免避免与醋等酸性物质一起烹饪、控制烹饪温度不超过400℃,
故答案为:避免与醋等酸性物质一起烹饪;控制烹饪温度不超过400℃;
(3)发生反应:KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L;
HCN?H++CN-的电离平衡常数Ka=$\frac{c({H}^{+})×c(C{N}^{-})}{c(HCN)}$,溶液呈中性,则c(H+)=c(OH-)=10-7 mol/L,由电荷守恒c(H+)+c(K+)=c(CN-)+c(Cl-)+c(OH-),故c(K+)=c(CN-)+c(Cl-),则c(CN-)=(0.5a-0.005)mol/L,根据物料守恒c(HCN)=0.5amol/L-c(CN-)=0.005mol/L,则Ka=$\frac{c({H}^{+})×c(C{N}^{-})}{c(HCN)}$=$\frac{1{0}^{-7}×(0.5a-0.005)}{0.005}$mol•L-1 =(100a-1)×10-7 mol•L-1
故答案为:>;(100a-1)×10-7 mol•L-1;
(4)催化剂的特点,恢复原来状态,则Fe3+→Fe2+,故Fe3+将SO2氧化为硫酸,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,上述转化的重要意义在于:可以消除SO2的污染,同时制得硫酸,变废为宝,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;以消除SO2的污染,同时制得硫酸,变废为宝;
(5)c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=1.1×10-3 mol•L-1>1×10-5 mol•L-1,故Fe3+没有沉淀完全,
故答案为:c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=1.1×10-3 mol•L-1>1×10-5 mol•L-1,故Fe3+没有沉淀完全.
点评 本题考查化学方程式计算、弱电解质电离、溶度积有关计算等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案| A. | 1:1 | B. | 15:13 | C. | 7:8 | D. | 8:7 |
| A. | SO2用于粉丝漂白 | B. | Al2O3用于耐高温材料 | ||
| C. | 甲醛用于食品防腐 | D. | 石灰水用于工业制漂白粉 |
| A. | 常温常压下测得1 mol N2的质量为28 g | |
| B. | 用量筒测得排水法收集到的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.5 g胆矾,受热充分失水后,固体质量减轻0.9 g |
| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
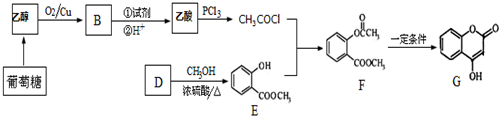
 2CH3CHO+2H2O
2CH3CHO+2H2O 
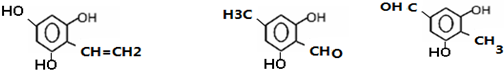 (其中一种)
(其中一种)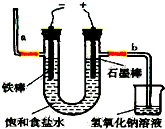 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答: