题目内容
13.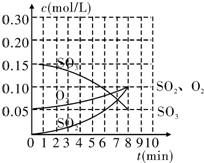 在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.(1)在0~4min内生成O2的平均速率v(O2)=0.0025 mol/(L•min).
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=0.4.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是BD,此时的平衡常数与(2)中相比相等(填“增大”、“减小”或“不变”).
| 选项 | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
分析 (1)根据v=$\frac{△c}{△t}$计算v(O2);
(2)平衡时二氧化硫、氧气浓度为0.1mol/L,三氧化硫浓度为0.05mol/L,平衡常数K=$\frac{{c}^{2}(S{O}_{2})×c({O}_{2})}{{c}^{2}(S{O}_{3})}$;
(3)A.等效为开始加入3mol SO3(g)和1mol氧气,与原平衡为完等效平衡,平衡时相同组分的浓度相等;
B.相当于在原来的基础上加入1.5molSO2,抑制平衡向正反应方向移动;
C.等效为在原平衡的基础上移走1mol氧气,平衡正向移动;
D.6molSO2和5molO2等效为开始加入6molSO3和2molO2,相当于在原来的基础上缩小体积,平衡向生成SO3的方向移动;
平衡常数只受温度影响,温度不变,平衡常数不变.
解答 解:(1)反应至4min时,氧气的浓度为0.06mol/L,则v(O2)=$\frac{0.06mol/L-0.05mol/L}{4min}$=0.0025mol/(L.min),故答案为:0.0025;
(2)平衡时二氧化硫、氧气浓度为0.1mol/L,三氧化硫浓度为0.05mol/L,则平衡常数K=$\frac{{c}^{2}(S{O}_{2})×c({O}_{2})}{{c}^{2}(S{O}_{3})}$=$\frac{0.{1}^{2}×0.1}{0.0{5}^{2}}$=0.4,故答案为:0.4;
(3)A.等效为开始加入3mol SO3(g)和1mol氧气,与原平衡为完等效平衡,平衡时三氧化硫的浓度为0.05mol/L;
B.相当于在原来的基础上加入1.5molSO2,抑制平衡向正反应方向移动,平衡时三氧化硫浓度大于0.05mol/L;
C.等效为在原平衡的基础上移走1mol氧气,平衡正向移动,平衡时三氧化硫的浓度小于0.05mol/L;
D.6molSO2和5molO2等效为开始加入6molSO3和2molO2,相当于在原来的基础上缩小体积,平衡向生成SO3的方向移动,则达到平衡时,三氧化硫浓度大于0.05mol/L;
因反应在相同温度下进行,则平衡常数相同,
故答案为:BD;等于.
点评 本题考查化学平衡计算、等效平衡等,难度中等,关键是对等效平衡的理解掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | υ(A)=0.5 mol/(L•s) | B. | υ(B)=18 mol/(L•min) | C. | υ(C)=0.8 mol/(L•s) | D. | υ(D)=1 mol/( L•s) |
 2CH3CHO+2H2O
2CH3CHO+2H2O 
 (其中一种)
(其中一种)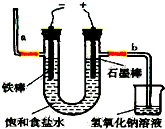 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答: 如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线:
如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线: