题目内容
14.下列物质属于离子化合物是( )| A. | SO2 | B. | H2O | C. | HCl | D. | NaOH |
分析 含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.二氧化硫分子中只存在共价键,为共价化合物,故A错误;
B.水分子中只存在共价键,为共价化合物,故B错误;
C.氯化氢分子中只存在共价键,为共价化合物,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物,故D正确;
故选D.
点评 本题考查离子化合物和共价化合物判断,侧重考查基本概念,明确物质中存在的化学键即可解答,注意二者区别,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
10.同主族元素的性质较为相似,下列关于同主族元素性质推测正确的是( )
| A. | Li、Na同主族,因为Na在空气中加热生成Na2O2,所以Li在空气中加热生成Li2O2 | |
| B. | F、Cl同主族,因为HCl是强酸,所以HF也是强酸 | |
| C. | Li、Na同主族,因为Na保存在煤油中,所以Li也保存在煤油中 | |
| D. | F、Cl同主族,因为Cl2也是有色气体,所以F2也是有色气体 |
2.氮化硼是一种新合成的无机材料,它是一种超硬耐磨、耐高温、抗腐蚀的物质.下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间的作用力类型相同的是( )
| A. | 硫酸钠和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 苯和四氯化碳 |
6.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g) 达平衡的标志是( )
| A. | v正(N2)=$\frac{1}{3}$v正(H2) | B. | v正(N2)=3v逆(H2) | C. | v正(H2)=$\frac{3}{2}$v逆(NH3) | D. | v正(H2)=$\frac{2}{3}$v逆(NH3) |
3.氯化钙(CaCl2)是一种很好的道路融雪剂、防冻剂和防尘剂,对路面和路基有良好的养护作用.下列叙述一定能说明CaCl2是离子晶体的是( )
| A. | CaCl2固体不导电,但在熔融状态下可以导电 | |
| B. | CaCl2的水溶液能导电 | |
| C. | CaCl2易溶于水 | |
| D. | CaCl2在有机溶剂(如苯)中的溶解度极小 |
4.宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O,下列说法正确的是( )
| A. | Ag是还原剂 | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | Ag2S既是氧化产物又是还原产物 |
 ;
; ;
; .
. ;
; .
.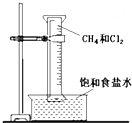 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题: