题目内容
3.氯化钙(CaCl2)是一种很好的道路融雪剂、防冻剂和防尘剂,对路面和路基有良好的养护作用.下列叙述一定能说明CaCl2是离子晶体的是( )| A. | CaCl2固体不导电,但在熔融状态下可以导电 | |
| B. | CaCl2的水溶液能导电 | |
| C. | CaCl2易溶于水 | |
| D. | CaCl2在有机溶剂(如苯)中的溶解度极小 |
分析 离子晶体是由离子构成的,熔化时克服的是离子键,产生自由移动的离子,能导电,而分子晶体、原子晶体熔化时,不能产生自由移动的离子,不导电,以此解答该题.
解答 解:A、CaCl2固体不导电,但在熔融状态下可导电,说明在熔融状态下电离出自由移动的离子,一定能说明CaCl2是离子晶体,故A正确;
B、水溶液导电性较强,但不能说明是离子化合物,如HCl水溶液也能导电,但HCl为分子晶体,故B错误;
C、二氧化硫易溶于水,但是分子晶体,所以晶体类型与溶解性无关,故C错误;
D、大多数无机物在有机溶剂中的溶解度较小,不能说明是否离子化合物,故D错误.
故选A.
点评 本题是对各类晶体的含义、构成微粒、作用力的理解,为高频考点,侧重于基础知识的综合理解和运用的考查,应从本质上理解掌握,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列叙述中正确的是( )
| A. | 硅单质广泛用于制作光导纤维 | |
| B. | SO2使氯水褪色,说明SO2具有漂白性 | |
| C. | 氯气泄漏后应顺风向低处跑 | |
| D. | 酸雨的pH值小于5.6 |
14.下列物质属于离子化合物是( )
| A. | SO2 | B. | H2O | C. | HCl | D. | NaOH |
11.下列分子属于手性分子的是( )
| A. | H2O | B. |  | C. |  | D. | H2N-CH2-COOH |
15.下列有关碱金属的说法正确的是( )
| A. | 碱金属元素随原子序数的递增原子半径逐渐减小 | |
| B. | 碱金属元素随原子序数的递增离子氧化性逐渐减弱 | |
| C. | 碱金属元素的单质在氧气点燃都生成过氧化物 | |
| D. | 碱金属元素随原子序数的递增最高价氧化物对应的水化物碱性逐渐减弱 |
12.下列有关说法正确的是( )
| A. | NH3(g)+HCl(g)→NH4Cl(s),该反应可自发进行,故熵值增大 | |
| B. | SO2(g)→S(s)+O2(g)△H>0,△S<0.则该反应能自发进行 | |
| C. | O2(g)+2H2(g)═2H2O(l)△H<0,恒温恒压下一定能自发进行 | |
| D. | 某温度下2SO2(g)+O2(g)═2SO3(g),K1=400,则相同温度下2SO3(g)?2SO2(g)+O2(g)的平衡常数为$\frac{1}{400}$ |
13.下列有机物的命名正确的是( )
| A. | 2,4,6-三硝基甲苯 | B. | 3-甲基-1,3-丁二烯 | ||
| C. | 1,1,2,2-四甲基戊烷 | D. | 2-甲基-3-丁醇 |

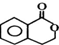

 ;F
;F
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2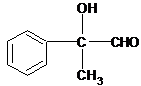 +2H2O
+2H2O +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.