题目内容
9.现有4种元素A、B、C、D.已知A-离子核外有18个电子;B原子最外层电子数与D原子核外电子数相同,且B原子比D原子多两个电子层;D+离子核外没有电子;C元素原子核外电子比B元素原子核外电子多5个.(1)写出这四种元素的符号:
A:Cl B:NaC:S D:H
(2)画出B、C原子和A-离子的结构示意图:
 ;
; ;
; .
.(3)分析元素A、元素B在元素周期表中的位置:A元素位于第三周期、ⅦA族;B元素位于第三周期、第ⅥA族
(4)分别写出D元素与A元素组成的化合物及B元素与C元素形成的化合物的电子式:
 ;
; .
.
分析 现有4种元素A、B、C、D.已知A-离子核外有18个电子,则A为Cl;D+离子核外没有电子,则D为H元素;B原子比D原子多两个电子层,则B处于第三周期,B原子最外层电子数与D原子核外电子数相同,处于IA族,故B为Na;C元素原子核外电子比B元素原子核外电子多5个,C原子核外电子数为16,故C为S元素,据此解答.
解答 解:现有4种元素A、B、C、D.已知A-离子核外有18个电子,则A为Cl;D+离子核外没有电子,则D为H元素;B原子比D原子多两个电子层,则B处于第三周期,B原子最外层电子数与D原子核外电子数相同,处于IA族,故B为Na;C元素原子核外电子比B元素原子核外电子多5个,C原子核外电子数为16,故C为S元素.
(1)由上述分析可知,A为Cl,B为Na,C为S,D为H,故答案为:Cl;Na;S;H;
(2)Na原子结构示意图为 ,S原子结构示意图为
,S原子结构示意图为 ,Cl-离子的结构示意图为
,Cl-离子的结构示意图为 ,
,
故答案为: ;
; ;
; ;
;
(3)A为Cl元素,原子核外有3个电子层,最外层电子数为7,处于元素周期表中第三周期ⅦA族,B为S元素,原子核外有3个电子层,最外层电子数为6,处于元素周期表中第三周期ⅥA族,
故答案为:三;ⅦA;三;ⅥA;
(4)D元素与A元素组成的化合物为HCl,电子式为 ,B元素与C元素形成的化合物为Na2S,电子式为
,B元素与C元素形成的化合物为Na2S,电子式为 ,
,
故答案为: ;
; .
.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,有利于基础知识的巩固.

练习册系列答案
相关题目
20.关于同分异构体的叙述正确的是( )
| A. | 相对分子质量相同而结构不同的化合物互称为同分异构体 | |
| B. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| C. | 同分异构体之间由于分子组成相同,所以它们的性质相同 | |
| D. | 只有少数的有机物之间存在同分异构现象 |
17.已知正丁烷的二氯代物有6种同分异构体,则其八氯代物的同分异构体的数目为( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
4.下列关于有机物的说法错误的是( )
| A. | CCl4可由CH4反应得到,可萃取碘水中的碘 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
14.下列物质属于离子化合物是( )
| A. | SO2 | B. | H2O | C. | HCl | D. | NaOH |
1.下列5种烃:①2-甲基戊烷 ②2,2-二甲基丙烷 ③己烷 ④庚烷 ⑤戊烷,按它们的沸点由高到低的顺序排列正确的是( )
| A. | ①>②>③>④>⑤ | B. | ②>③>⑤>④>① | C. | ④>③>②>①>⑤ | D. | ④>③>①>⑤>② |
19.按如图所示装置进行实验,下列现象描述正确的是(不加热)( )


| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| C. | 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓硝酸,B为石墨,D将看到红棕色气体 |
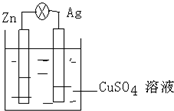 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.