题目内容
20.100mL 12mol/L的硝酸与30g的Ag-Cu混合物反应,共收集到6.72L的气体,并测得反应后溶液中氢离子浓度为2mol/L(设体积不变),求混合物中Ag的质量.分析 根据n=cV计算出反应前后硝酸的物质的量,从而得出反应过程中消耗硝酸的总物质的量;设出混合物中银、铜的物质的量,然后分别根据总质量、N原子守恒列式计算即可.
解答 解:12mol/L的硝酸为浓硝酸,反应后氢离子浓度为2mol/L,则反应后变成了稀硝酸,故反应过程中生成的6.72L气体为NO和二氧化氮的混合物,
设混合金属中Ag的物质的量为x、Cu的物质的量为y,反应生成气体的总物质的量为:=0.3mol,
根据总质量可得:①108x+64y=30,
反应后的溶液中的氢离子浓度与剩余硝酸的浓度相等,反应后剩余硝酸的物质的量为:2mol/L×0.1L=0.2mol,反应过程中消耗硝酸的总物质的量为:12mol/L×0.1L-0.2mol=1mol,
反应生成硝酸银、硝酸铜中含有硝酸根离子的物质的量为:x+2y,NO和二氧化氮中含有N原子的物质的量为:0.3mol,
则:②1mol=0.3mol+x+2y,
联立①②解得:x=0.1mol、y=0.3mol,
则混合物中含有银的质量为:108g/mol×0.1mol=10.8g,
答:混合物中含有银的质量为10.8g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
10.下列装置或操作能达到目的是( )
| A. | 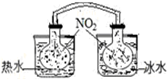 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 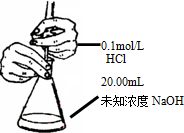 测定锥形瓶内的NaOH的浓度 | |
| C. | 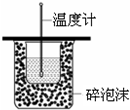 测定中和热 | |
| D. | 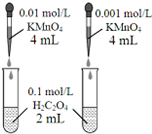 依据褪色快慢比较浓度对反应速率的影响 |
5.已知自然界氯元素有35Cl,37Cl两种同位素,则自然界中的Cl2有( )
| A. | 2种 | B. | 4种 | C. | 3种 | D. | 6种 |
6.下列说法正确的是( )
| A. | 苯在催化剂作用下能与溴水发生取代反应 | |
| B. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| C. | 氯乙烷在氢氧化钠的水溶液中生成乙烯 | |
| D. | 将苯、浓HNO3的混合物用水浴加热(60℃左右)制备硝基苯 |


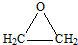 .
.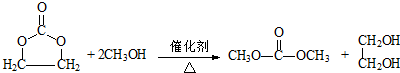 .
.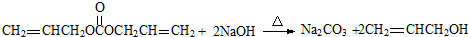 .
. .
. ;③C、D形成的化合物的电子式
;③C、D形成的化合物的电子式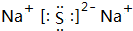 ;
;
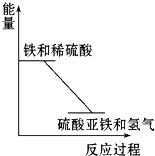 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示: