题目内容
15.标准状况时,将2.12g Na2CO3固体加入到100mL某浓度的盐酸中恰好完全反应生成CO2,计算:(1)得到CO2气体的体积;
(2)该盐酸的物质的量浓度.
分析 发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,根据n=$\frac{m}{M}$计算碳酸钠的物质的量,在根据方程式计算HCl、二氧化碳的物质的量.
(1)根据V=nVm计算二氧化碳的体积;
(2)根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:2.12g Na2CO3的物质的量为$\frac{2.12g}{106g/mol}$=0.02mol,
Na2CO3+2 HCl═2NaCl+CO2↑+H2O
1 2 1
0.02mol 0.04mol 0.02mol
(1)得到CO2气体的体积为0.02mol×22.4L/mol=0.448L,
答:标况下得到CO2气体的体积为0.448L;
(2)该盐酸的物质的量浓度为$\frac{0.04mol}{0.1L}$=0.4mol/L,
答:该盐酸的物质的量浓度为0.4mol/L.
点评 本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
5.常温下,下列叙述正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分别在等体积的②、④两溶液加水稀释100倍,所得溶液中水电离出的c(H+)相等 | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+) |
10.短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的3倍,回答下列问题:
(1)甲在元素周期表中的位置第三周期ⅣA族;
(2)原子半径:甲>丁(填“<”、“>”或“=”);
(3)元素的非金属性:甲<丙(填“<”、“>”或“=”).
| 乙 | 丙 | 丁 | |
| 甲 | 戊 |
(2)原子半径:甲>丁(填“<”、“>”或“=”);
(3)元素的非金属性:甲<丙(填“<”、“>”或“=”).
1.2012年4月22日是第43个“世界地球日”,其主题为“绿色梦 想,低碳行动”.下列做法符合这一主题的是( )
①开发太阳能、风能和氢能等能源
②大量开采地下水,以满足生产、生活的需求
③使用布袋购物、以步代车等属于“低碳生活”方式
④开发利用可燃冰是缓解能源紧缺的唯一途径
⑤利用可降解的“玉米塑料”生产一次性饭盒.
①开发太阳能、风能和氢能等能源
②大量开采地下水,以满足生产、生活的需求
③使用布袋购物、以步代车等属于“低碳生活”方式
④开发利用可燃冰是缓解能源紧缺的唯一途径
⑤利用可降解的“玉米塑料”生产一次性饭盒.
| A. | ①③⑤ | B. | ①②③ | C. | ②④⑤ | D. | ①②④ |
19.决定化学反应速率的主要因素是( )
| A. | 反应物的浓度 | B. | 反应是否为可逆反应 | ||
| C. | 反应是否使用催化剂 | D. | 反应物的性质 |

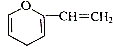
 、
、 、
、 ;
;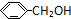 ;
;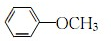 .
.