题目内容
【题目】草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿(主要成分为Co2CuS4,一定量CuFeS2)为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程:
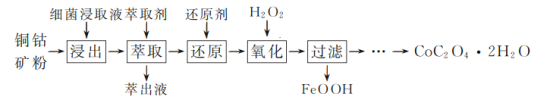
已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co3+、![]() ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③草酸钴晶体难溶于水;25℃时,Ksp[Co(OH)2]=1.6×10-15。
回答下列问题:
(1)生产时为提高铜钴矿粉浸出率,常采取的措施有________(填字母)。
a.适当延长浸出时间b.高温浸出c.分批加入细菌浸取液并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是________。
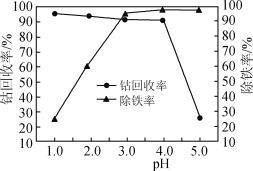
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
①用电子式表示H2O2的形成过程________。
②“氧化”过程的离子方程式为________。
③pH为4~5时,钴的回收率降低的原因是________。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______________。
(5)300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,该反应的化学方程式为________。
【答案】ac Cu2+ ![]() 2Fe2++H2O2+2H2O
2Fe2++H2O2+2H2O![]() 2FeOOH+4H+ pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低 取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净 3CoC2O4·2H2O+2O2
2FeOOH+4H+ pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低 取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净 3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O
Co3O4+6CO2+6H2O
【解析】
由题给流程可知,铜钴矿粉加入细菌浸取液浸取后,得到的溶液中含有的离子有H+、Fe3+、Cu2+、Co2+、SO42-;向溶液中加入萃取剂,用萃取剂除去溶液中的Cu2+;向萃取后的溶液中加入还原剂,将Fe3+还原为Fe2+,然后加入H2O2,将Fe2+氧化为FeOOH沉淀,除去溶液中的铁元素;过滤后,向滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体。
(1)a.适当延长浸出时间可以使反应更充分,提高浸出率,故正确;
b. 高温条件下可以加快反应速率,但是细菌在高温条件下会死亡,故不能用高温,故错误;
c. 分批加入细菌浸取液并搅拌能使反应物混合更均匀,更充分,提高浸出率,故正确;
ac正确,故答案为:ac;
(2)由流程分析可知,后续的操作不能除去Cu2+,故只能在萃取步骤中除去Cu2+,故答案为:Cu2+;
(3)①H2O2为共价化合物,分子中含有极性共价键和非极性共价键,用电子式表示过氧化氢的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
②由题意可知,氧化过程为70℃、pH=4条件下,过氧化氢与亚铁离子发生氧化还原反应生成FeOOH,反应的离子方程式为2Fe2++H2O2+2H2O![]() 2FeOOH+4H+,故答案为:2Fe2++H2O2+2H2O
2FeOOH+4H+,故答案为:2Fe2++H2O2+2H2O![]() 2FeOOH+4H+;
2FeOOH+4H+;
③由题给信息可知,溶液pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成较多的胶体,氢氧化铁胶体具有很大的吸附能力,吸附大量Co2+,导致钴回收率降低,故答案为:pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低;
(4)由流程可知,草酸钴晶体表面附有可溶的硫酸铵,检验晶体是否洗涤干净实际上就是检验洗涤液中是否存在硫酸根,则检验方法为取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净,故答案为:取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净;
(5)由题意可知,300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,反应中Co元素化合价升高,依据氧化还原反应规律,空气中的O2参与反应,做反应的氧化剂,Co元素和C元素被氧化,反应的化学方程式为3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O,故答案为:3CoC2O4·2H2O+2O2
Co3O4+6CO2+6H2O,故答案为:3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O。
Co3O4+6CO2+6H2O。