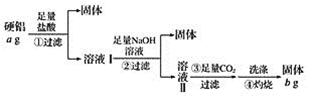
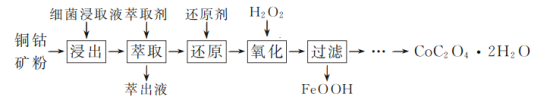
题目内容
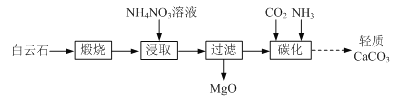
【题目】以白云石(主要成分为CaCO3和MgCO3)为原料制备氧化镁和轻质碳酸钙的一种工艺流程如下:
已知:Ksp[Mg(OH)2] = 5×1012
(1)白云石高温煅烧所得固体产物的主要成分为_______(填化学式)。
(2)NH4NO3溶液呈酸性的原因为_______(用离子方程式表示)。
(3)“浸取”后,c(Mg2+)应小于5×106 mol·L1,则需控制溶液pH ______。
(4)“碳化”反应的化学方程式为_______。
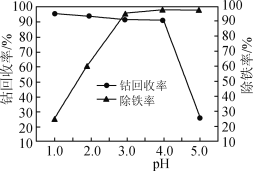
(5)煅烧所得固体的活性与其中CaO含量及固体疏松程度有关。其他条件相同时,将不同温度下的煅烧所得固体样品加入酸化的酚酞溶液中,引起溶液变色所需时间不同,由此可知煅烧所得固体的活性差异。溶液变色的时间与各样品煅烧温度的关系如图所示。当温度高于950 ℃时,煅烧所得固体易板结,活性降低;当温度低于950 ℃时,活性降低的原因为_______。将不同温度下的煅烧所得固体样品加入水中,也可测量其活性,则此时需测量的数据为相同时间后_______与样品煅烧温度之间的关系。

【答案】CaO、MgO NH![]() + H2O
+ H2O![]() NH3·H2O+H+ >11 Ca(NO3)2+ CO2 + 2NH3 = CaCO3↓+ 2NH4NO3 煅烧温度较低,CaCO3未完全分解,CaO的含量偏低 温度
NH3·H2O+H+ >11 Ca(NO3)2+ CO2 + 2NH3 = CaCO3↓+ 2NH4NO3 煅烧温度较低,CaCO3未完全分解,CaO的含量偏低 温度
【解析】
白云石(主要成分为CaCO3和MgCO3)高温煅烧得到CaO和MgO,由于铵根水解显酸性,所以之后加入硝酸铵调节pH浸取,使CaO溶解,浸取后溶液中的溶质主要为硝酸钙和一水合氨,过滤掉不溶的MgO,之后向溶液中依次通入过量氨气、二氧化碳,得到碳酸钙。
(1)高温煅烧白云石得到CaO和MgO;
(2)硝酸铵溶液中由于存在铵根的水解所以显碱性,水解方程式为NH![]() + H2O
+ H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)Ksp[Mg(OH)2] =c2(OHˉ)·c(Mg2+),当c(Mg2+)=5×106 mol·L1时,c(OHˉ)=![]() mol/L=1×10-3mol/L,此时pH=11,若c(Mg2+)小于5×106 mol·L1,则需要pH>11;
mol/L=1×10-3mol/L,此时pH=11,若c(Mg2+)小于5×106 mol·L1,则需要pH>11;
(4)硝酸铵浸取后溶液中的溶质主要为硝酸钙和一水合氨,通入氨气、二氧化碳,发生复分解反应,化学方程式为Ca(NO3)2+ CO2 + 2NH3 = CaCO3↓+ 2NH4NO3;
(5)煅烧温度较低,CaCO3未完全分解,CaO的含量偏低,所以活性降低;氧化钙和水反应放热,氧化钙含量越高与样品与水反应放出的热量越多,所以也可将不同温度下的煅烧所得固体样品加入水中,测量的相同时间后反应液的温度与样品煅烧温度之间的关系,来判断样品的活性。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
B | 加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液,溶液紫红色褪去 | 有乙烯生成 |
C | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,充分反应后,萃取分液,向水层中滴加KSCN溶液,溶液呈血红色 | I-与Fe3+的反应有一定限度 |
D | 向NaHCO3溶液中滴加紫色石蕊试液,溶液变蓝 | Kw<Ka1(H2CO3)×Ka2(H2CO3) |
A.AB.BC.CD.D