题目内容
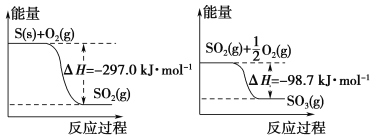
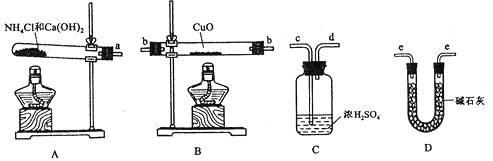
【题目】喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据如图,回答下列问题:
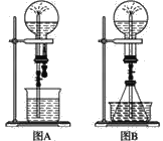
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是(________)
A.氯化氢和水
B.氯气和氢氧化钠溶液
C.氯化氢和汽油
D.二氧化碳和氢氧化钠溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是(________)
A.铜与稀盐酸
B.碳酸氢钠与氢氧化钠溶液
C.碳酸钙与稀硫酸
D.碳酸氢铵与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是(________)。
A.浓硫酸 B.生石灰
C.硝酸铵 D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是__上部烧瓶内压强;城市中常见的人造喷泉及火山爆发的原理与上述__(填“图A”或“图B”)装置的原理相似。
【答案】C D C 减小 图B
【解析】
(1)依据形成喷泉的条件是烧瓶中的气压变小的要求分析解答即可;
(2)依据加入的物质能导致锥形瓶中气压变大的原理才能产生喷泉的知识分析解答;
(3)在图B锥形瓶外放一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的物质,结果也产生了喷泉,就必须要求水槽中加入的物质后能使锥形瓶中的温度明显升高;
(4)图A原理是使烧瓶中气体压强减小形成喷泉;城市中常见的人造喷泉及火山爆发的原理与图B原理相似。
(1)该装置中形成喷泉的条件是烧瓶中的气压变小,可以是烧瓶中的气体减少或者是烧瓶中的温度减小等原因造成;
A.HCl和H2O,氯化氢极易溶于水中,能够使烧瓶中的气体体积减小,所以能够形成喷泉,故A不符合题意;
B.Cl2和NaOH溶液,氯气能够与氢氧化钠溶液反应,能使烧瓶中的气体减小,所以能够形成喷泉,故B不符合题意;
C.Cl2和汽油,氯气不溶于汽油,所以不能使烧瓶中的气体减小,无法形成喷泉,故C符合题意;
D.CO2和NaOH溶液能迅速反应,能导致烧瓶中的气体减小,所以能形成喷泉,故D不符合题意;
故答案为:C;
(2)图B是在锥形瓶中加入的物质能导致锥形瓶中气压变大才能形成喷泉;
A.Cu与稀盐酸不反应,所以不能导致锥形瓶中的气压变大,无法形成喷泉,故A错误;
B.碳酸氢钠和NaOH溶液能反应,但不能导致锥形瓶中的气压变大,故B错误;
C.CaCO3与稀硫酸反应生成硫酸钙,硫酸钙为微溶物,阻止了反应继续进行,所以无法形成喷泉,故C错误;
D.碳酸氢铵与稀盐酸反应生成二氧化碳气体,能导致锥形瓶中的气压变大,所以能够形成喷泉,故D正确;
故答案为:D;
(3)A.浓硫酸溶于水放出大量的热使酒精蒸发产生大量酒精蒸气,使锥形瓶内压强大大增加,可以形成喷泉,故A不符合题意;
B.生石灰与水反应生成氢氧化钙,反应放出大量的热,可以使锥形瓶中压强增大,所以能够形成喷泉,故B不符合题意;
C.硝酸铵与乙醇不反应,不能导致锥形瓶中压强增大,无法形成喷泉,故C符合题意;
D.烧碱溶于水中放出大量的热量,导致锥形瓶中温度升高,压强增大,所以能够形成喷泉,故D不符合题意;
故答案为:C;
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是减小了烧瓶中的压强形成喷泉;城市中常见的人造喷泉及火山爆发的原理都是通过增加容器中的压强完成的,所以与图B原理相似。

 阅读快车系列答案
阅读快车系列答案