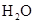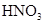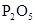题目内容
(15分)某探究小组废弃的印刷线路板(含Cu、A1少量Au、Pt等金属的混合物)回收Cu并制备硫酸铝晶体[A12(SO4)3.18H2O],设计路线如下:
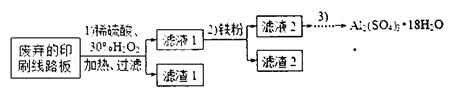
(1)过滤时所需要的玻璃仪器有玻璃棒、 、 。
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 。
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量。实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式:
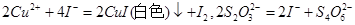
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 。
②滴定终点观察到的现象为 。
③若滴定前溶液中的H2O2没有除尽,所测定的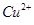 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲: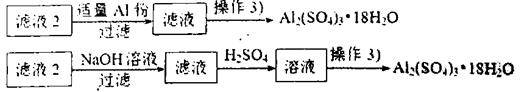
乙:
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤。
②从原子利用率角度考虑, 方案更合理。(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
①氧化需加入H2O2而不用C12的原因是 。
②调节溶液pH约为 。

(1)过滤时所需要的玻璃仪器有玻璃棒、 、 。
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 。
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量。实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式:
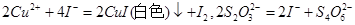
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 。
②滴定终点观察到的现象为 。
③若滴定前溶液中的H2O2没有除尽,所测定的
 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:

乙:
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤。
②从原子利用率角度考虑, 方案更合理。(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的
 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
②调节溶液pH约为 。
(1)漏斗、烧杯(2分)
(2)取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现(,说明洗涤干净)(或其他合理答案)(2分)
(3)①Na2S2O3标准溶液润洗2~3次(1分)
②溶液蓝色恰好褪去(且半分钟内不恢复)(1分)③偏高(2分)
(4)①冷却结晶(1分)过滤(1分)②甲(1分)
(5)①不引入杂质,对环境无污染(2分)②3. 2~3. 8(答3.5等也可以)(2分)
(2)取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现(,说明洗涤干净)(或其他合理答案)(2分)
(3)①Na2S2O3标准溶液润洗2~3次(1分)
②溶液蓝色恰好褪去(且半分钟内不恢复)(1分)③偏高(2分)
(4)①冷却结晶(1分)过滤(1分)②甲(1分)
(5)①不引入杂质,对环境无污染(2分)②3. 2~3. 8(答3.5等也可以)(2分)
(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗和烧杯。
(2)沉淀变慢吸附的有SO42-,据此可以检验,即取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现。
(3)①滴定管在装入标准液之前,除了需要蒸馏水洗涤外,还需要用标准液润洗,即还需要用Na2S2O3标准溶液润洗2~3次。
②由于碘能和淀粉发生显色反应,据此可以判断终点,即溶液蓝色恰好褪去(且半分钟内不恢复)。
③由于双氧水也能氧化碘离子,所以消耗的标准液偏多,测定结果偏高。
(4)①从溶液中得到晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤。
②方案乙中,还生成硫酸钠,原子利用率低。所以甲方案更合理。
(5)①双氧水的还原产物是水,不引入杂质,对环境无污染。
②根据表中数据可知,氢氧化铝开始沉淀时的pH是3.8,所以范围是3. 2~3. 8。
(2)沉淀变慢吸附的有SO42-,据此可以检验,即取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现。
(3)①滴定管在装入标准液之前,除了需要蒸馏水洗涤外,还需要用标准液润洗,即还需要用Na2S2O3标准溶液润洗2~3次。
②由于碘能和淀粉发生显色反应,据此可以判断终点,即溶液蓝色恰好褪去(且半分钟内不恢复)。
③由于双氧水也能氧化碘离子,所以消耗的标准液偏多,测定结果偏高。
(4)①从溶液中得到晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤。
②方案乙中,还生成硫酸钠,原子利用率低。所以甲方案更合理。
(5)①双氧水的还原产物是水,不引入杂质,对环境无污染。
②根据表中数据可知,氢氧化铝开始沉淀时的pH是3.8,所以范围是3. 2~3. 8。

练习册系列答案
相关题目
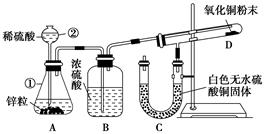
 2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)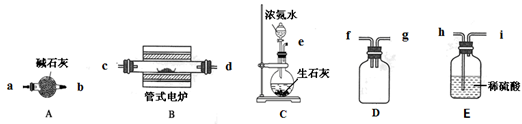
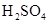
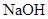 溶液
溶液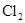
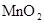
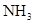
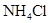 溶液
溶液