题目内容
(9分)用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
| | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.50mL |
| 第二次 | 0.20mL | 18.80mL |
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
(1)0.148或0.15mol/L ,
(2) 滴最后一滴溶液由无色变浅红色,半分钟不褪色
(3)A. D.E
(2) 滴最后一滴溶液由无色变浅红色,半分钟不褪色
(3)A. D.E
试题分析:(1)根据表格中数据可知消耗氢氧化钠体积的平均值为18.50 mL,
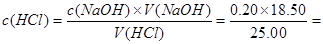 0.148mol/L。
0.148mol/L。(2)达到滴定终点的标志是滴最后一滴溶液由无色变浅红色,半分钟不褪色。
(3)
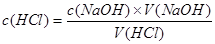 来分析结果是否变高,主要是看氢氧化钠的体积,A项混有Na2CO3杂质,消耗氢氧化钠的体积偏大,结果偏高;B项滴定终点读数时,俯视滴定管的刻度,氢氧化钠的体积偏小,结果偏低;C项无影响;D项滴定管尖嘴处悬挂一滴溶液,说明氢氧化钠的体积偏大,导致待测液浓度偏大;E项未用标准液润洗碱式滴定管,导致标准液浓度偏小,需要的体积变大,使待测液浓度变大。
来分析结果是否变高,主要是看氢氧化钠的体积,A项混有Na2CO3杂质,消耗氢氧化钠的体积偏大,结果偏高;B项滴定终点读数时,俯视滴定管的刻度,氢氧化钠的体积偏小,结果偏低;C项无影响;D项滴定管尖嘴处悬挂一滴溶液,说明氢氧化钠的体积偏大,导致待测液浓度偏大;E项未用标准液润洗碱式滴定管,导致标准液浓度偏小,需要的体积变大,使待测液浓度变大。点评:误差分析主要考虑标准液的体积偏大、偏小等。属于较简单题。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目


 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。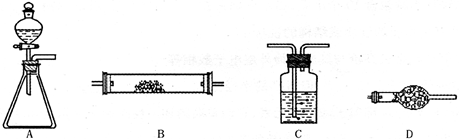
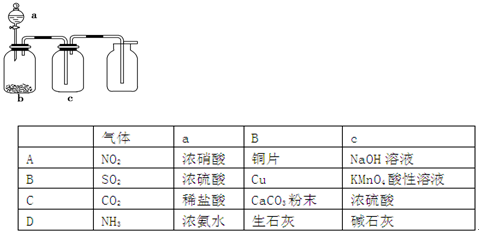
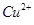 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
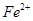 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。