题目内容
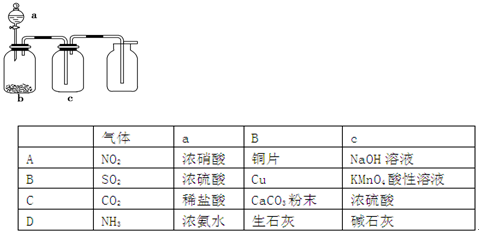
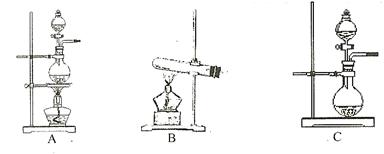
(14分)某实验小组利用如下仪器组装一套制备氮化硼晶体的装置。
反应原理是B2O3 + 2NH3 2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
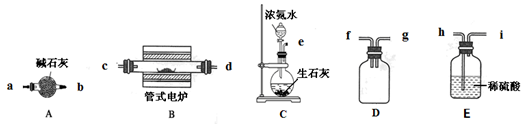
(1)各仪器接口由左到右的连接顺序为 。
(2)实验过程分为如下操作:①提纯BN ②滴加浓氨水③添加药品④连接装置
⑤加热管式电炉⑥检查装置气密性⑦取出反应混合物⑧停止加热,继续通一段时间的氨气。则正确的操作顺序为_______________________ (填序号)。
(3)装置D的作用是 。
(4)装置C能产生氨气的原因有 (答出其中一项即可)。
(5)管式电炉加热反应前必须进行的一步操作是 ,反应结束时,继续通一段时间氨气的目的是 。
(6)除去产物中未反应的B2O3并得到纯净的BN固体的实验操作是__________。
反应原理是B2O3 + 2NH3
 2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
2BN + 3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
(1)各仪器接口由左到右的连接顺序为 。
(2)实验过程分为如下操作:①提纯BN ②滴加浓氨水③添加药品④连接装置
⑤加热管式电炉⑥检查装置气密性⑦取出反应混合物⑧停止加热,继续通一段时间的氨气。则正确的操作顺序为_______________________ (填序号)。
(3)装置D的作用是 。
(4)装置C能产生氨气的原因有 (答出其中一项即可)。
(5)管式电炉加热反应前必须进行的一步操作是 ,反应结束时,继续通一段时间氨气的目的是 。
(6)除去产物中未反应的B2O3并得到纯净的BN固体的实验操作是__________。
(14分)(1)eabcdfgh (2)④⑥③②⑤⑧⑦① (3)防止倒吸
(4)氨水中存在可逆反应NH3+H2O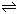 NH3?H2O
NH3?H2O 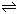 NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。
NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。
(5)除去装置中的氧气;冷却反应混合物防止BN被氧化。
(6)将粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干
(4)氨水中存在可逆反应NH3+H2O
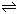 NH3?H2O
NH3?H2O 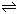 NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。
NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。(5)除去装置中的氧气;冷却反应混合物防止BN被氧化。
(6)将粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干
(1)C装置是制取氨气的,由于氨气中含有水蒸气,所以首先要干燥氨气,剩余的氨气还需要进行尾气处理。由于氨气极易溶于水,所以还需要装置D来防止倒吸,所以正确的顺序是eabcdfgh。
(2)装置连接好以后,首先要检验装置的气密性。由于BN高温下能被空气氧化,不溶于水,所以反应结束后,还需要继续通一段时间的氨气,所以正确的顺序是④⑥③②⑤⑧⑦①。
(3)由于氨气极易溶于水,所以还需要装置D来防止倒吸。
(4)由于氨水中存在可逆反应NH3+H2O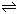 NH3?H2O
NH3?H2O 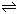 NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。
NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。
(5)由于BN高温下能被空气氧化,所以管式电炉加热反应前必须进行的一步操作是除去装置中的氧气;同样分析可知,反应结束时,继续通一段时间氨气的目的是冷却反应混合物防止BN被氧化。
(6)由于B2O3难溶于冷水但可溶于热水,所以除去产物中未反应的B2O3并得到纯净的BN固体的实验操作是将粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干即可。
(2)装置连接好以后,首先要检验装置的气密性。由于BN高温下能被空气氧化,不溶于水,所以反应结束后,还需要继续通一段时间的氨气,所以正确的顺序是④⑥③②⑤⑧⑦①。
(3)由于氨气极易溶于水,所以还需要装置D来防止倒吸。
(4)由于氨水中存在可逆反应NH3+H2O
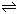 NH3?H2O
NH3?H2O 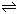 NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。
NH4+ + OH-,生石灰与水反应消耗水,促使氨气放出;或生石灰与水反应生成氢氧化钙电离出大量OH-,反应逆向进行有利于NH3放出;或生石灰与水反应放出大量热,促进NH3?H2O分解,并使气体溶解度下降,有利于NH3放出。(5)由于BN高温下能被空气氧化,所以管式电炉加热反应前必须进行的一步操作是除去装置中的氧气;同样分析可知,反应结束时,继续通一段时间氨气的目的是冷却反应混合物防止BN被氧化。
(6)由于B2O3难溶于冷水但可溶于热水,所以除去产物中未反应的B2O3并得到纯净的BN固体的实验操作是将粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干即可。

练习册系列答案
相关题目

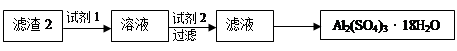
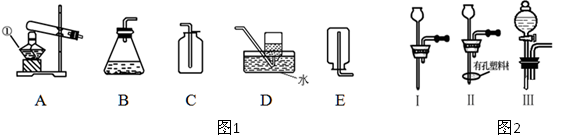
 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
 Na2CO3 + H2O +CO2↑
Na2CO3 + H2O +CO2↑
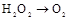
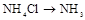
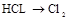
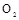 的装置制备
的装置制备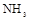 ,应选择的试剂为 .
,应选择的试剂为 .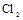 需用
需用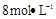 的盐酸1OOml,现用
的盐酸1OOml,现用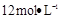 的盐酸来配制。
的盐酸来配制。
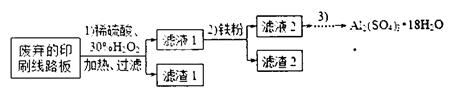
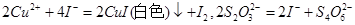
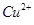 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
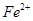 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。