题目内容
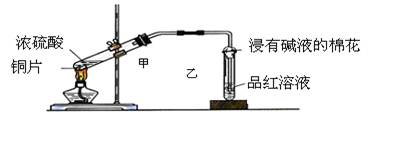
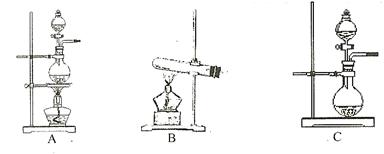
(7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。
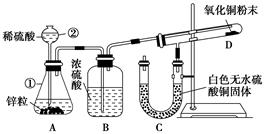
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。

(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。
(1)锥形瓶 长颈漏斗 (2)除去H2中的水蒸气 (3)D
(4)白色无水CuSO4固体变蓝 黑色CuO逐渐变红 (5)2
(4)白色无水CuSO4固体变蓝 黑色CuO逐渐变红 (5)2
(1)根据仪器的结构可知,①是锥形瓶,②是长颈漏斗。
(2)由于参加反应的氢气应该是干燥的,所以浓硫酸的作用是除去H2中的水蒸气。
(3)氢气还原氧化铜需要加热,所以答案选D。
(4)氢气还原氧化铜的方程式为H2+CuO=Cu+H2O,所以D中的现象是黑色CuO逐渐变红;C中的现象是白色无水CuSO4固体变蓝。
(5)根据方程式可知,氧化铜中Cu元素的化合价从+2价降低到0价,所以生成1个水分子时,转移2个电子。
(2)由于参加反应的氢气应该是干燥的,所以浓硫酸的作用是除去H2中的水蒸气。
(3)氢气还原氧化铜需要加热,所以答案选D。
(4)氢气还原氧化铜的方程式为H2+CuO=Cu+H2O,所以D中的现象是黑色CuO逐渐变红;C中的现象是白色无水CuSO4固体变蓝。
(5)根据方程式可知,氧化铜中Cu元素的化合价从+2价降低到0价,所以生成1个水分子时,转移2个电子。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

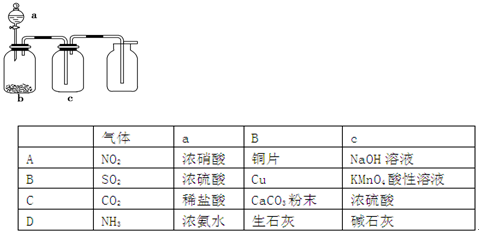

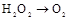
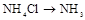
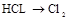
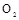 的装置制备
的装置制备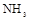 ,应选择的试剂为 .
,应选择的试剂为 .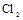 需用
需用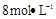 的盐酸1OOml,现用
的盐酸1OOml,现用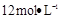 的盐酸来配制。
的盐酸来配制。
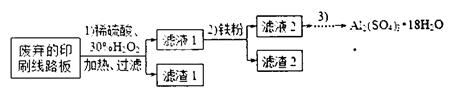
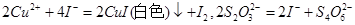
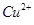 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
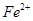 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。