题目内容
19.碱金属(如锂、钠、钾、铷等)溶于汞中形成良好的还原剂“汞齐”.取某种碱金属的汞齐7g,与足量水作用得到0.2g氢气,并得到密度为ρ•cm-3的溶液1L,则溶液中溶质的质量分数可能是( )| A. | ($\frac{0.8}{ρ}$)% | B. | ($\frac{0.48}{ρ}$)% | C. | ($\frac{0.32}{ρ}$)% | D. | ($\frac{0.7}{ρ}$)% |
分析 汞不能与水反应,碱金属(M)与水反应的化学方程式为:2M+2H2O=2MOH+H2↑,设M质量为x(x<7g),相对原子质量为a,则x=0.2ag<7g,故a<35.相对原子质量小于35的碱金属只有锂和钠,由此分析解答.
解答 解:汞不能与水反应,碱金属(M)与水反应的化学方程式为:2M+2H2O=2MOH+H2↑,设M质量为x(x<7g),相对原子质量为a,则x=0.2ag<7g,故a<35.相对原子质量小于35的碱金属只有锂和钠,如果是Li,生成LiOH是0.2mol就是4.8g,溶液质量为1000p,所以LiOH%=0.48%/p,B正确;如果是Na,生成NaOH是0.2mol就是8g,NaOH%=0.8%/p,A是正确,故选AB.
点评 本题考查活泼金属与水反应后,求溶质的质量分数,首先根据生成气体的量来分析金属的组成,然后综合讨论,有一定的难度.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
9.简单原子的原子结构可用如图的表示方法来形象表示,其中“黑球”表示质子或电子,“白球”表示中子.则下列有关①、②、③的叙述中正确的是( )
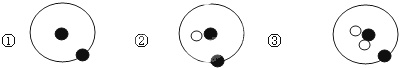

| A. | ①、②、③互为同位素 | B. | ①、②、③互为同素异形体 | ||
| C. | ①、②、③是三种化学性质不同的核素 | D. | ①、②、③质量数相同 |
10.“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
7.一定条件下,X(g)+3Y(g)?2Z(g)达到化学平衡的标志是( )
| A. | Z的分解速率和生成速率相等 | |
| B. | X、Y、Z的浓度不再变化 | |
| C. | 反应体系的总质量保持不变 | |
| D. | 单位时间内生成nmolZ,同时生成nmolX |
14.化学键是( )
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
8.分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,在一定条件下B能转化成C.下列说法正确的是( )
| A. | 有机物B的红外线谱图出现C=O键的振动吸收 | |
| B. | 有机物C的核磁共振氢谱有可能是三个吸收峰 | |
| C. | 有机物A的结构可能有4种 | |
| D. | 有机物C可以发生缩聚反应 |
9.下列反应必须加入氧化剂且一步反应就能完成的是( )
| A. | N2→NH3 | B. | N2→NO | C. | N2→NO2 | D. | NO2→NO |
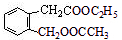 ,D的名称是乙醇.
,D的名称是乙醇.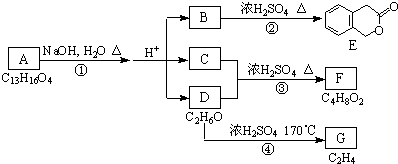
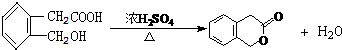 .
.