题目内容
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同) _
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是_ _
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_ 作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_ 。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_ 0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
(1)③>②>④>①⑵③>②>①>④⑶酚酞,c(H+)=10-(14-a)mol/L;(4)>,(100b-1)×10-7 mol?L-1.
解析试题分析:(1)由于pH相同的几种溶液,即氢离子浓度相同,弱酸是难电离的,故③CH3COOH的浓度是最大,①H2SO4溶液HSO4-中可以看作是比一元强酸稍大的酸,故浓度最小。其物质的量浓度由大到小的顺序是③>②>④>①。 (2)常温下,将足量的锌粉说明酸完全反应了,这与酸最终提供的氢离子量有关,故顺序为③>②>①>④。 (3)由于终点时生成强碱弱酸盐呈碱性,因此选择在碱性范围内变色的指示剂,应选用酚酞作指示剂,若终点时溶液pH = a,此时OH-全是水电离产生,则由水电离的氢离子和氢氧根相等。c(H+)=10-(14-a)mol/L。(4)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L; HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,c(CN-)=(a?0.01)/2(等体积混合,原浓度都减半)c(HCN)=0.01/2,带入公式,Ka=10-7?(b-0.01)/0.01=(100b-1)×10-7 mol?L-1,故答案为:>;(100b-1)×10-7 mol?L-1.
考点:本题考查了难溶物的电离平衡,涉及到了较多的计算,难度较大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)①25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。 
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |

(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2
 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。 物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”)。
(2)25℃时,某HCl溶液中c(HCl)=1×10-4 mol·L-1,则该溶液的pH= ,此时c(H+)H2O= mol/L。加水稀释1000倍,则稀释后溶液中pH____ _7(填“>”“<”或“=”)。
(3)t2℃时,将pH=11的氢氧化钠钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(2)NaAlO2溶液呈碱性的原因是 (用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH="8." 8的NaOH溶液 B. pH="5." 2的NH4Cl溶液 C.pH="5." 2的盐酸
D. 0. 1 mol/L的NaCN溶液 E.pH="8." 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为 。
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。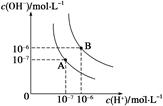
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
 H++SO42-。
H++SO42-。