题目内容
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H+ + S042-。
H+ + S042-。
请回答下列有关问题:
(1)Na2SO4溶液呈_(填“弱酸性”、“中性”或“弱碱性”),其理由是_
(用离子方程式表示)。
(2)H2SO4溶液与BaC12溶液反应的离子方程式为_ 。
(3)在0.l0mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是_ (填写编号)。
| A.c(Na+)=c(SO42-)+c(HSO4一)+c(H2SO4) |
| B.c(OH-)="c(" HSO4-)+c(H+) |
| C.c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c( Na+)=2c(SO42-)+2c(HSO4-) |
(5)若25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)= mol·L-1
(1)弱碱性;SO42-+H2O HSO4-+OH-;
HSO4-+OH-;
(2)Ba2++HSO4-=BaSO4↓+H+
(3)BCD;
(4)<;H2SO4=HSO4-+H+,电离出的H+抑制HSO4-的电离;
(5)0.01
解析试题分析:(1)HSO4- H+ + SO42-存在电离平衡,SO42-要发生水解,溶液呈现弱碱性;(2)HSO4-为弱酸酸式酸根书写离子方程式不拆写;(3)B为质子守恒;C为电荷守恒;D为物料守恒;(4)略;(5)0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则=0.11mol·L-1,硫酸一级电离出c(H+)为0.1mol·L-1,因此0.11-0.1=0.01,多电离出的H+为二级电离所得,即C(SO42-)=0.01mol·L-1。
H+ + SO42-存在电离平衡,SO42-要发生水解,溶液呈现弱碱性;(2)HSO4-为弱酸酸式酸根书写离子方程式不拆写;(3)B为质子守恒;C为电荷守恒;D为物料守恒;(4)略;(5)0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则=0.11mol·L-1,硫酸一级电离出c(H+)为0.1mol·L-1,因此0.11-0.1=0.01,多电离出的H+为二级电离所得,即C(SO42-)=0.01mol·L-1。
考点:电离平衡的计算。

(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近 。
(3)25℃时,下列四种溶液中,①pH=0的盐酸 ②0.1 mol·L–1的盐酸 ③0.01 mol·L–1的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是: (填字母)
| A.1︰10︰100︰1000 | B.0︰1︰12︰11 |
| C.14︰13︰12︰11 | D.14︰13︰2︰3 |
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) = ;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) = ;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)= 。
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用________(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___________________________________________________。
(3)Ⅱ中加Cu2(OH)2CO3的目的是___________________________________,
其优点是_____________________________________________________________。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___________________________。
(5)V中加H2SO4调节pH=1是为了_________________________________________,
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是______________,
若你是工程师,将对所加的A物质作何改进?请提出建议______________________。
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)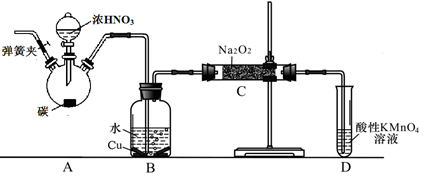
(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
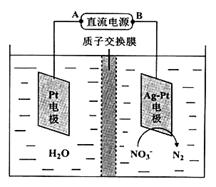
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。


 2G(g)。忽略
2G(g)。忽略
