��Ŀ����
�Ӻ�ˮ����ȡþ������������þ����Ҫ��Դ����������ȡþ�Ĺ������漰�ļ������ʵ��ܶȻ�����������ѧ��֪ʶ�ش����м������⣺
| ���� | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| �ܶȻ� | 2.8��10�C9 | 6.8��10�C6 | 5.5��10�C6 | 1.8��10�C11 |
(1)�ڴӺ�ˮ����ȡþʱ�������õ�����(��Ҫ�ɷ���̼���)������Ϊ (��ܡ����ܡ�)��������ĥ�ɷ�ĩֱ��Ͷ�뺣ˮ�У������� ���������ֱ��Ͷ�룬Ӧ���������δ�������д����ѧ����ʽ ��
(2)ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ (����ԡ������ԡ�)�õ�Mg(OH)2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ��������� (��ܡ����ܡ�)��Mg2+ת��ΪMg(OH)2������������ (�����ӷ���ʽ��ʾ)��
(3)��֪��ˮ��þ����Ũ��Ϊ1.8��10�C3mol��L�C1����Ҫʹþ���Ӳ�����������Һ��PH���ӦΪ ��
(1)����(1��)�� ������ĥ�ɷ�ĩ����CaCO3��CaCO3���ܽ�ȱ�MgCO3���ܽ��С�����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3(2��)�� CaCO3 CaO + CO2��(2��)�� (2)����(1��)��
CaO + CO2��(2��)�� (2)����(1��)��
��(1��)�� CO32�C + Mg2+ = MgCO3��MgCO3 + 2OH�C = Mg(OH)2 + CO32�C(4��) (3)10(2��)
�������������(1)������ĥ�ɷ�ĩ����CaCO3��CaCO3���ܶȻ���MgCO3���ܶȻ�С�����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3��Ӧ���������ճ�CaO��CaOͶ�뺣ˮ�����ɵ�Ca(OH)2ʹ��ˮ�е�Mg2+ת��ΪMg(OH)2������(2)NaOH�������OH�C����Mg2+��Ӧ����Mg(OH)2������Mg(OH)2���ܶȻ�MgCO3���ܶȻ�������ͨ�����ռӦ��MgCO3����ת��ΪMg(OH)2������MgCO3 + 2OH�C = Mg(OH)2 + CO32�C��(3)Ksp[Mg(OH)2]=c(Mg2+)��c2(OH�C)=1.8��10�C3��c2(OH�C)=1.8��10�C11�������c(OH�C)=1��10�C4����pH=10��
���㣺����������ת�����ܶȻ����йؼ��㡢���ӷ���ʽ����д��

 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�������, Ũ�Ⱦ�Ϊ0. 1 mol/L��6����Һ��pH���±�:
| ��� | a | b | c | d | e | f |
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
��2��NaAlO2��Һ�ʼ��Ե�ԭ���� (�����ӷ���ʽ��ʾ)������Һ�����������õ��Ĺ�������� ��
��3����ϱ������ݷ���, ��0. 1 mol/L��CH3COONa��Һ��ˮ�ĵ���̶���ͬ��������(����ĸ����)��
A.pH="8." 8��NaOH��Һ B. pH="5." 2��NH4Cl��Һ C.pH="5." 2������
D. 0. 1 mol/L��NaCN��Һ E.pH="8." 8��Na2CO3��Һ
��4����Ũ�Ⱦ�Ϊ0. 1 mol/L��b��c��������, ������Һ�и�����Ũ�ȹ�ϵ��ȷ���� ��
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
��5��0.2 mol/LHCl��0.1 mol/L NaAlO2��Һ����������Һ������Ũ��˳��Ϊ ��
��1��ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ95 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���95��ʱ0.1 mol��L��1��NaOH��Һ�У���ˮ������� c(H��)= mol��L��1��Kw(25 ��) Kw(95��)(�>������<������)��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl ���壬��ˮ�ĵ���ƽ���Ӱ���� (��ٽ����������ơ���Ӱ�족)��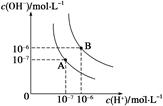
��2��25��ʱ����0.1L 0.2 mol��L-1��HA��Һ�У���0.001mol��HA��������ӣ������Һ��pH= �������Ϊ ��
��3������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ ��
| ��ѧʽ | ����ƽ�ⳣ��(25 ��) |
| HCN | K��4.9��10��10 |
| H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��1��25��ʱ��ijNaCl��Һ��c(Cl�C)��1��10��4 mol��L�C1�������Һ��c(Na��)��c(OH��)��
��2��25��ʱ����0.1 mol��L�C1NaOH��Һ��0.06 mol��L�C1��H2SO4��Һ��������(���Ի�Ϻ�����ı仯)����������Һ��pH�� ��25��ʱ��pHֵΪ8��NaOH��Һ��pHֵΪ10��NaOH��Һ�������Ϻ���Һ��������Ũ����ӽ� ��
��3��25��ʱ������������Һ�У���pH=0������ ��0.1 mol��L�C1������ ��0.01 mol��L�C1��NaOH��Һ ��pH=11��NaOH��Һ����ˮ��������������Ũ��֮�Ȣ٩U�کU�۩U���ǣ� (����ĸ)
| A��1�U10�U100�U1000 | B��0�U1�U12�U11 |
| C��14�U13�U12�U11 | D��14�U13�U2�U3 |
������¶���ˮ��Kw�� ��
���ڸ��¶��²��ij��ҺpH��3�������Һ��c(H��)��c(OH��)��________��
�۸��¶��½�pH=2�������pH=11������������Һ�������ϣ�pH=______________
��5�� ��ˮ��c(H+)=5.0��10�C7 mol��L�C1�����ʱ��ˮ�е�c(OH�C) = �����¶Ȳ��䣬����ϡ����ʹc(H+)=5.0��10�C3 mol��L�C1����c(OH�C) = ���ڸ��¶�ʱ����ˮ�е���NaOH��Һ����Һ�е�c(OH�C)=5.0��10�C2 mol��L�C1������Һ��c(H+)= ��
 ��ֵ �����������С�����䡱����
��ֵ �����������С�����䡱���� X2��+H+���ش��������⣺
X2��+H+���ش��������⣺ ��2����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��AlCl3�����Һ����μ��백ˮ�������� ���ѧʽ����������֪25��ʱKsp[Fe(OH)3]=2.6��10��39 mol4��L��4��KsP[Al(OH)3]=1.3��10��33 mol4��L��4��
��2����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��AlCl3�����Һ����μ��백ˮ�������� ���ѧʽ����������֪25��ʱKsp[Fe(OH)3]=2.6��10��39 mol4��L��4��KsP[Al(OH)3]=1.3��10��33 mol4��L��4��