题目内容
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4)的一种流程如下:
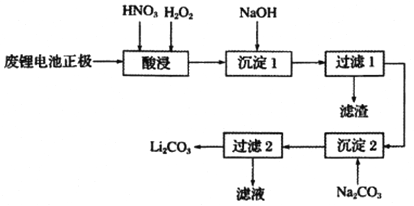
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_______________________________________________________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是___________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________。
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________;HClO氧化除去氨氮的反应离子方程式是_________________________________。
【答案】隔绝空气和水分 2LiMn2O4+10H++3H2O2===2Li++4Mn2++3O2↑+8H2O 反应生成Cl2,污染环境 沿着玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复操作2~3次 MnO2作为催化剂,降低了碳酸锂的分解温度 H2SO4溶液,固体溶解,加入 Na2CO3,并控制溶液 pH<7.7,过滤,用少量的乙醇洗涤,在低于100 ℃条件下真空干燥 2Cl--2e-=C12↑ 2NH4++3HClO=N2+3H2O+5H++3Cl-
【解析】
(1)金属锂是碱金属,极易与氧气和水反应,所以废旧电池拆解时,应该注意隔绝空气和水分;
故答案为:隔绝空气和水分;
(2)根据已知条件推断可知,LiMn2O4与HNO3和H2O2反应生成Mn ( NO3)2、LiNO3,离子方程式为:2LiMn2O4+10H++3H2O2===2Li++4Mn2++3O2↑+8H2O,如果采用盐酸溶解LiMn2O4,反应过程中会产生Cl2,造成环境污染;
故答案为:2LiMn2O4+10H++3H2O2===2Li++4Mn2++3O2↑+8H2O;反应生成Cl2,污染环境;
(3) Li2CO3沉淀生成时,会有Na2CO3残留,所以过滤2过程中需要进行洗涤过滤,操作为:沿着玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复操作2~3次;
故答案为:沿着玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复操作2~3次;
(4) 升温到515℃时,开始有CO2产生,同时生成固体A,由于二氧化锰是催化剂,加快了碳酸锂分解速率,达到碳酸锂分解的时间减少,所以比预计碳酸锂的分解温度(723℃)低很多;
故答案为:MnO2作为催化剂,降低了碳酸锂的分解温度;
(5)①若pH≥7.7,会生成Mn(OH)2沉淀,所制得的MnCO3不纯,所以在加入NaHCO3(或Na2CO3)过程中,要向Mn(OH)2中边搅拌边加入硫酸溶液控制溶液的pH<7.7;②充分反应后,得到MnCO3沉淀,过滤,并用少量水洗涤沉淀2~3次,洗涤的目的是除去附着在沉淀表面的SO42-;③用水洗法洗涤沉淀不一定能将附着在沉淀表面的离子洗干净,故需要检验SO42-是否除尽;④由题已知条件可知,潮湿的MnCO3易被空气氧化,所以在SO42-被除去之后,用少量乙醇再次洗涤,乙醇沸点低,易挥发,易带走MnCO3沉淀表面的水分,可有效防止MnCO3被氧化;⑤当温度高于100 ℃时,MnCO3开始分解,所以在干燥MnCO3过程中,须在隔绝空气的条件下,将温度控制在100 ℃以下;
故答案为:H2SO4溶液,固体溶解,加入 Na2CO3,并控制溶液 pH<7.7,过滤,用少量的乙醇洗涤,在低于100 ℃条件下真空干燥;
(6) ①电解时,根据放电顺序,阳极是氯离子先失去电子,电极反应式是:2Cl--2e-=C12↑,HClO氧化除去氨氮反应的产物要对环境污染小,所以次氯酸与铵根反应生成氮气和氢离子,离子方程式是:2NH4++3HClO=N2+3H2O+5H++3Cl-;
故答案为:2Cl--2e-=C12↑;2NH4++3HClO=N2+3H2O+5H++3Cl-。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。