题目内容
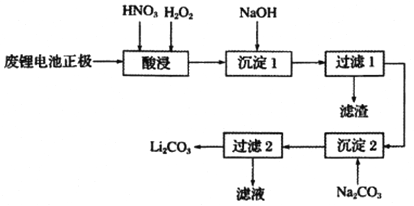
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
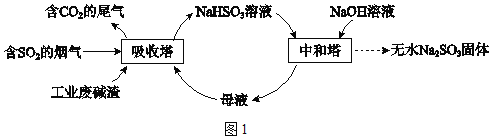
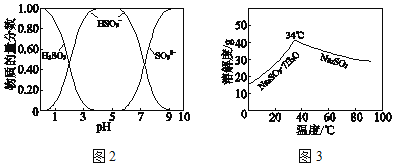
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO37H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
【答案】CO32﹣+H2OOH﹣+HCO3﹣ 4~5 溶液中,HSO3﹣存在:HSO3﹣H++SO32﹣和HSO3﹣+H2OH2SO3 +OH﹣,HSO3﹣的电离程度强于水解程度 防止SO2的溶解度下降 防止HSO3﹣受热分解,防止HSO3﹣的氧化速率加快等 隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
【解析】
(1)Na2CO3为强碱弱酸盐,在溶液中CO32-发生水解反应,消耗水电离产生的H+,使溶液解呈碱性,水解的离子方程式为CO32-+H2O![]() OH-+HCO3-;
OH-+HCO3-;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②NaHSO3溶液中存在电离平衡HSO3-![]() H++SO32-和水解平衡HSO3-+H2O
H++SO32-和水解平衡HSO3-+H2O![]() H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
③已知:①SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) △H1=-164.3kJ/mol
②CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) △H2=-109.4kJ/mol
③2HSO3-(aq)═SO32-(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
利用盖斯定律将①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式为2SO2(g)+CO32-(aq)+H2O(l)=2HSO3-(aq)+CO2(g) △H=-88.9 kJ/mol,
④HSO3-不稳定,易分解,如果温度过高,可导致气体的溶解度下降,且HSO3-易被氧化,因此吸收塔的温度不易过高,否则HSO3-的氧化速率加快等;
(3)得无水Na2SO3固体,温度应高于34℃,且为防止Na2SO3被氧化,要隔绝空气,加热浓缩至有大量固体析出。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下列实验方案不能达到相应目的是
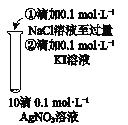
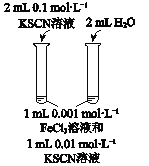
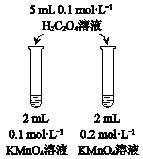
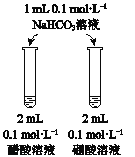
A | B | C | D | |
目的 | 比较AgCl和AgI的溶解度大小 | 研究浓度对化学平衡的影响 | 研究浓度对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. A B. B C. C D. D
【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |