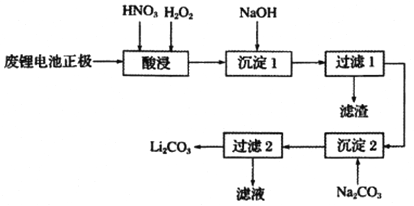
题目内容
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
【答案】D
【解析】
试题A中,a点处溶液呈中性,而所给出的离子中,碳酸根离子会水解使得溶液呈碱性,故A错。B中,b点处溶液呈酸性,但是溶液中还有硝酸根离子,即相当于有硝酸存在,强氧化性的硝酸不会允许有还原性的二价铁离子的存在,故B错。C点对应的溶液呈中性,但是铝离子的水解会使得溶液呈酸性,故C错。D中d点所对应的溶液一定呈碱性与题意符合,所以D正确。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1____0 (填“>”、“=”或“<”)。
② 某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为___________,此时的温度为_______(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_________________________________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①该电池的能量转化形式为___________________________。
②工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。_____________________________
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为___________mol/L(假设电解前后溶液体积不变)。