题目内容
4.下列有关物质结构的表述正确的是( )| A. | 次氯酸的电子式: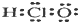 | B. | 氯化钠的分子式:NaCl | ||
| C. | 二氧化碳的比例模型: | D. | Cl-的结构示意图: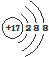 |
分析 A.次氯酸分子的中心原子为O,其分子中不存在氢氯键;
B.氯化钠属于离子化合物,不存在氯化钠分子;
C.二氧化硫为直线形结构,不是V形;
D.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构.
解答 解:A.次氯酸为共价化合物,分子中存在1个氢氧键和1个氧氯键,次氯酸正确的电子式为: ,故A错误;
,故A错误;
B.NaCl离子化合物,NaCl为氯化钠的化学式,不存在氯化钠分子,故B错误;
C.二氧化碳分子中存在两个碳氧双键,为直线形结构,二氧化碳正确的比例模型为: ,故C错误;
,故C错误;
D.氯离子的核电荷数为17,最外层为8个电子,氯离子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、比例模型、离子结构示意图、分子式与化学式的概念及区别,试题侧重考查学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.室温下,pH值相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加水稀释2倍后,两溶液的pH均减小 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加适量的醋酸钠晶体后,两溶液的pH均增大 | |
| D. | 加足量的锌充分反应后,醋酸和盐酸产生的氢气一样多 |
9.常温下,下列说法中,正确的是( )
| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
16.下列物质与酸的反应中,只表现出酸性作用的是( )
| A. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | B. | C+4HNO3(浓)═CO2↑+4NO2↑+2H2O | ||
| C. | 3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O | D. | CuO+2HNO3(稀)═Cu(NO3)2+H2O |
13.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为物质系数.在2s内,用X表示平均速率为0.3m/p mol/(L•s),则在2s内,Q物质增加的物质的量为( )
| A. | 1.2q/p mol | B. | 1.2m/p mol | C. | 0.6q/p mol | D. | 0.3q/p mol |
14.舍勒在研究一种白色盐时发现,在黑暗中这种盐并无气味,而在光照条件下变黑,并产生一种刺激性气味(无液体).这种盐是( )
| A. | AgBr | B. | AgI | C. | AgCl | D. | KClO3 |