题目内容
9.常温下,下列说法中,正确的是( )| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
分析 A、0.1mol/L的HNO3溶液中氢离子浓度为0.1mol/L,依据离子积常数计算水电离处的氢离子浓度和氢氧根离子浓度相同;
B、向水中加入酸或碱抑制水电离,加入含有弱根离子的盐促进水电离,根据某物质的溶液中由水电离出的c(H+)和纯水中c(H+)相对大小判断是促进水电离还是抑制水电离;
C、碳酸氢钠是强电解质完全电离;
D、NH3•H2O和NH4Cl混合液pH=7,结合溶液电荷守恒分析,溶液中存在阴阳离子电荷总数相同.
解答 解:A、0.1mol/L的HNO3溶液中由水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L<$\sqrt{{K}_{W}}$=10-7mol/L,故A正确;
B、某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,说明水电离出的氢离子浓度增大,则溶液是水解的盐,若是弱酸强碱盐,溶液PH=14-a,若是强酸弱碱盐,PH=a,则pH不一定为a,故B错误;
C、碳酸氢钠是强电解质完全电离,在小苏打水溶液中存在的电离平衡有:HCO3-?CO32-+H+,H2O?H++OH-,故C错误;
D、NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(Cl-)>c(H+)=c(OH-),c(NH4+)≠c(NH3•H2O),故D错误;
故选A.
点评 本题考查了水的电离平衡影响因素分析判断,电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
2.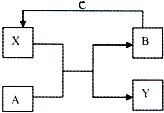 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )| A. | 若X是光导纤维的主要成分,工业上常利用反应I制备B,Y的化学式为CO | |
| B. | 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若组成A的元素在短周期中原子半径最大(稀有气体除外),以Y为电解质溶液,气体B为燃料,C为氧化剂可构成燃料电池,工作一段时间后,Y溶液的pH增大 | |
| D. | 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,Y的电子式为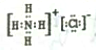 |
17.H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ•mol-1已知: (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )
 (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
4.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式: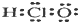 | B. | 氯化钠的分子式:NaCl | ||
| C. | 二氧化碳的比例模型: | D. | Cl-的结构示意图: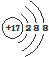 |
14.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
| A. | 消耗氧化铜的质量不同 | B. | 消耗铁的质量相同 | ||
| C. | 消耗硫酸的质量相同 | D. | 生成硫酸亚铁的质量不同 |
19.下列钠的化合物及其性质或用途不相符的是( )
| A. | Na2O2-淡黄色固体,可用做漂白剂 | B. | Na2O-白色固体,性质不稳定 | ||
| C. | NaHCO3-受热易分解,可用做发酵粉 | D. | Na2CO3-性质稳定,可治疗胃酸过多 |