题目内容
19.室温下,pH值相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )| A. | 加水稀释2倍后,两溶液的pH均减小 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加适量的醋酸钠晶体后,两溶液的pH均增大 | |
| D. | 加足量的锌充分反应后,醋酸和盐酸产生的氢气一样多 |
分析 盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比.
解答 解:A.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,故A错误;
B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误;
C.向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液的pH增大,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液的pH增大,故C正确;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的Zn反应,醋酸产生的氢气比盐酸多,故D错误;
故选C.
点评 本题考查了弱电解质电离,以及影响弱电解质的电离平衡的因素,注意pH相同醋酸和盐酸两种溶液,醋酸的浓度大,题目难度一般.

练习册系列答案
相关题目
12.据报道,近期我国研制出$\underset{\stackrel{18}{\;}}{8}{O}_{2}$分子,我国在在这方面居世界前列.下列有关$\underset{\stackrel{18}{\;}}{8}{O}_{2}$的叙述正确的是( )
| A. | 与$\underset{\stackrel{16}{\;}}{8}{O}_{2}$互为同位素 | B. | 与氧气具有相同的化学性质 | ||
| C. | 与氧气互为同素异形体 | D. | 与同质量的氧气具有相同的体积 |
14.下列物质中,属于电解质的是( )
| A. | Na | B. | HCl | C. | 酒精 | D. | NaOH溶液 |
4.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式: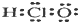 | B. | 氯化钠的分子式:NaCl | ||
| C. | 二氧化碳的比例模型: | D. | Cl-的结构示意图: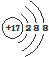 |
8.下列反应中,水作还原剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | 2F2+2H2O═4HF+O2 |
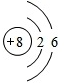 ;
;