题目内容
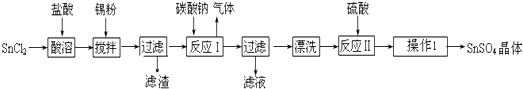
9.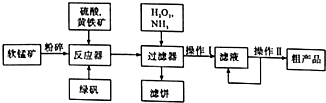 硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:(1)为了加快软锰矿与硫酸、黄铁矿反应的速率,工业上除采用粉碎软锰矿的方法,还可以用哪些方法加热、搅拌等.(写两种)
(2)流程中黄铁矿(主要含FeS2)和FeSO4的作用都是作还原剂,请写出FeSO4与软锰矿反应的离子方程式MnO2+4H++2Fe2+=Mn2++2H2O+2Fe3+.
(3)双氧水和氨水的作用分别是双氧化水氧化亚铁离子生成铁离子,氨水可以使铁离子生成氢氧化铁沉淀而除去.
(4)操作Ⅱ包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得MnSO4•H2O粗产品,洗涤中最好选用C.
A.浓硫酸 B.水 C.乙醇 D.浓硫酸.
分析 由流程可知,软锰矿(主要成分为MnO2,含有MgSO4等杂质)中加入硫酸、黄铁矿及绿矾,在反应器中反应生成硫酸锰,再用双氧水将溶液中的亚铁离子氧化成铁离子,用氨水调节pH值,使铁离子转化为氢氧化铁沉淀,过滤后除去氢氧化铁,将滤液蒸发浓缩、冷却结晶、过滤可得硫酸锰粗产品,滤液再循环利用,
(1)根据影响反应速率的因素可知,加热、搅拌等可以提高反应速率;
(2)FeSO4与软锰矿在酸性条件下将二氧化锰还原成+2价锰,亚铁离子被氧化成铁离子,根据电荷守恒和元素守恒书写离子方程式;
(3)双氧水是常见的氧化剂,能氧化亚铁离子,氨水可以使铁离子生成氢氧化铁沉淀而除去;
(4)从硫酸锰溶液中获取硫酸锰固体,可以通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,洗涤时要尽量减小硫酸锰的损失,据此选择.
解答 解:由流程可知,软锰矿(主要成分为MnO2,含有MgSO4等杂质)中加入硫酸、黄铁矿及绿矾,在反应器中反应生成硫酸锰,再用双氧水将溶液中的亚铁离子氧化成铁离子,用氨水调节pH值,使铁离子转化为氢氧化铁沉淀,过滤后除去氢氧化铁,将滤液蒸发浓缩、冷却结晶、过滤可得硫酸锰粗产品,滤液再循环利用,
(1)根据影响反应速率的因素可知,加热、搅拌等可以提高反应速率,
故答案为:加热、搅拌等;
(2)FeSO4与软锰矿在酸性条件下将二氧化锰还原成+2价锰,亚铁离子被氧化成铁离子,反应的离子方程式为MnO2+4H++2Fe2+=Mn2++2H2O+2Fe3+,
故答案为:MnO2+4H++2Fe2+=Mn2++2H2O+2Fe3+;
(3)双氧水是常见的氧化剂,能氧化亚铁离子,氨水可以使铁离子生成氢氧化铁沉淀而除去,
故答案为:双氧化水氧化亚铁离子生成铁离子,氨水可以使铁离子生成氢氧化铁沉淀而除去;
(4)从硫酸锰溶液中获取硫酸锰固体,可以通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,洗涤时要尽量减小硫酸锰的损失,所以选择乙醇洗涤,故选C,
故答案为:蒸发浓缩;冷却结晶;过滤;C.
点评 本题考查了硫酸锰的制取,涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,本题难度中等.

| A. | 配制100 g 10% CuSO4溶液,称取10 g硫酸铜晶体溶于90 g水中 | |
| B. | 将30%的乙醇溶液和70%的乙醇溶液等体积混和后所得乙醇溶液的质量分数为50% | |
| C. | 配制一定物质的量浓度的稀硫酸溶液时,称量浓硫酸时仰视量筒的刻度线 | |
| D. | 质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液 |
 已知:
已知:| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
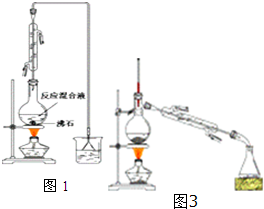
(一)制备1-溴丁烷粗产品:在图1装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)反应装置中加入沸石的目的是防止液体暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).

(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
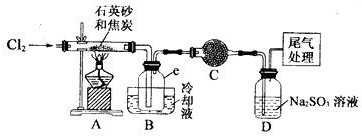
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑.装置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管;验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸;硅被氧化得不到高纯硅.
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>X>Y>W | D. | Z>Y>X>W |