题目内容
【题目】阿伏加德罗常数约为6.02×1023 mol﹣1(NA),下列说法正确的是( )
A.常温常压下,16g O2与16g O3所含的原子数均是NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为 NA
C.标准状况下,2.24LCCl4所含原子数为0.5NA
D.标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023
【答案】A
【解析】解:A.16gO2和O3所含的氧原子的质量为16g,含有1mol氧原子,含有的原子数为NA , 故A正确;B.物质的量浓度为0.5mol/L的MgCl2溶液中,溶液体积不知不能计算Cl﹣个数,故B错误;
C.标准状况下,2.24LCCl4物质的量不是0.1mol,故C错误;
D.标准状况下,22.4 L氦气物质的量= ![]() =1mol,氦气是单原子分子,所含有的质子数目约为2×6.02×1023 , 故D错误;
=1mol,氦气是单原子分子,所含有的质子数目约为2×6.02×1023 , 故D错误;
故选A.

练习册系列答案
相关题目
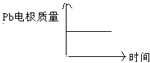
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D