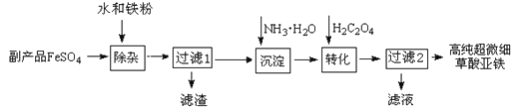
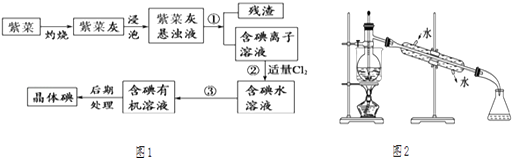
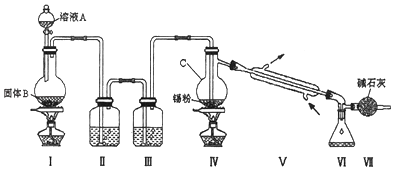
��Ŀ����
����Ŀ������һƿ��ǩ��ע��Ϊ���������εĸ��ϼ������ܺ����ơ�þ���ơ�����Ԫ�أ�ijͬѧΪ��ȷ�����еĽ���Ԫ�أ�ȡ���ָ��Ƽ���Ϊ��Һ����������ʵ�飮��֪����ҺpH=4ʱ��Fe3+������ȫ��Ca2+��Mg2+��������
��ش��������⣺
��1����������1����ܡ����ܡ���ȷ������Һ�к���Na+ ��
��2������3�а�ɫ�����Ļ�ѧʽ�� ��
��3����ҺA�м���H2O2��Һ��Ŀ���� ��
��4����������ʵ�飬�����ƶϳ������������εĸ��ϼ���һ�����е�Ԫ���� �� һ�������е�Ԫ���� ��
���𰸡�
��1������
��2��CaCO3
��3����Fe2+����ΪFe3+ �� ���ڼ���
��4��Ca��Fe��Mg
���������⣺��1���������NaOH ��aq����Na2CO3��aq��������Һ��������Na+ �� ���ܸ�����Һ��ɫ��Ӧ�Ļ�ɫ�����ж���Һ�Ƿ�Na+ �� ���Դ��ǣ����ܣ���2�����ݡ�������ҺpH=4ʱ��Fe��OH��3������ȫ��Ca2+��Mg2+����������Ϣ���ڹ��˳�ȥFe��OH��3����Һ�зֱ����NH3H2O��aq����Na2CO3��aq��������NH3H2O��aq������������˵����Һ�в���Mg2+ �� ����Na2CO3 ��aq��������ɫ������˵����Һ�к�Ca2+ �� ����3�а�ɫ�����Ļ�ѧʽ��CaCO3 �� ���Դ��ǣ�CaCO3����3����Һ����H2O2�����������ܱ�˫��ˮ����Ϊ�����ӣ����ڼ��飬�����ķ�ӦΪ2Fe2++H2O2+2H+�T2Fe3++2H2O�����Դ��ǣ���Fe2+����ΪFe3+ �� ���ڼ��飻��4����Һ����H2O2�����������ܱ�˫��ˮ����Ϊ�����ӣ����ݡ�������ҺpH=4ʱ��Fe��OH��3������ȫ��Ca2+��Mg2+����������Ϣ���ڹ��˳�ȥFe��OH��3����Һ�зֱ����NH3H2O��aq����Na2CO3��aq��������NH3H2O��aq������������˵����Һ�в���Mg2+ �� ����Na2CO3 ��aq��������ɫ������˵����Һ�к�Ca2+ �� ���Դ��ǣ�Ca��Fe��Mg��

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�����Ŀ����һ���¶��£�������X������Y��0.16mol���� 10L�����ܱ������У�������ӦX��g��+Y��g��2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±�������˵����ȷ���ǣ� ��
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.��Ӧǰ2min��ƽ������v��Z��=4.0��10��3mol/��Lmin��
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv���棩��v������
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D.�����������䣬�ٳ���0.2molZ��ƽ��ʱX�������������