题目内容
7.下列措施肯定能使化学反应速率增大的是( )①增大反应物的量 ②减小压强 ③升高温度 ④使用正催化剂.
| A. | ①②③ | B. | ③④ | C. | ②③④ | D. | ①②③④ |
分析 一般来说,升高温度、增大浓度、加入催化剂以及增大反应气体的压强,可增大反应速率,注意增大压强时,反应物的浓度增大,反应速率才能增大,以此解答.
解答 解:①如反应物为固体或纯液体,增大反应物的量,浓度不变,则反应速率不变,故①错误;
②如无气体参加反应,减小压强,则反应速率不变,故②错误;
③升高温度,活化分子数目增大,反应速率增大,故③正确;
④使用正催化剂,反应物活化能降低,反应速率增大,故④正确.
故选B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的理解和运用的考查,注意相关基础知识的积累,把握影响反应速率的因素和影响原因,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
17.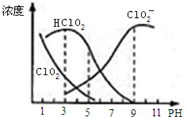 亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | 使用该漂白剂的最佳pH为3 | |
| D. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
18.下列说法正确的是( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在化学键
⑥熔融状态能导电的化合物一定是离子化合物.
①离子化合物一定含离子键,也可能含共价键
②共价化合物可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在化学键
⑥熔融状态能导电的化合物一定是离子化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
15.某气态烃1mol跟2molHCl加成,其加成产物又可被8molCl2完全取代,该烃可能( )
| A. | 丙烯 | B. | 1,3-丁二烯 | C. | 丙炔 | D. | 2-丁烯 |
2.下列各组反应(表中物质均为反应物)中,产生H2速度最快的是( )
| 编号 | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg,0.1 | 3 mol•L-1硫酸10ml | 60 |
| B | Mg,0.1 | 3 mol•L-1盐酸10ml | 60 |
| C | Fe,0.1 | 3 mol•L-1盐酸10ml | 60 |
| D | Mg,0.1 | 3 mol•L-1硫酸10ml | 50 |
| A. | A | B. | B | C. | C | D. | D |
12.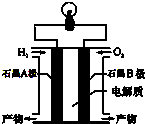 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 由于A、B两电极没有活动性差别,不能构成原电池 | |
| B. | A电极是负极,电极上发生氧化反应 | |
| C. | 产物为无污染的水,属于环境友好的绿色电池 | |
| D. | 外电路中电流由B电极通过导线流向A电极 |
19.一定物质的量浓度溶液的配置和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配置1mol•L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是( )
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60mL 稀硫酸标准溶液,配制时应选用100ML容量瓶 | |
| C. | 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | |
| D. | 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| E. | 配制溶液时,定容时俯视度数,则导致实验结果偏大 | |
| F. | 中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
17.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |