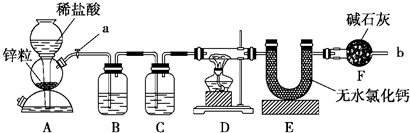
题目内容
5.多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2•2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2•2H2O的相对分子质量是244
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为SiCl4+4H2O=H4SiO4↓+4HCl.
(2)用H2还原SiCl4蒸汽可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol.
(3)加钡矿粉并调节pH=7的目的是①使BaCO3转化为BaCl2,②使Fe3+完全沉淀生成氢氧化铁沉淀.
(4)过滤②后的滤液中Fe3+浓度为2.2×10-17mo/L(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38).
(5)生成滤渣A的离子方程式Mg2++2OH-=Mg(OH)2↓.
(6)列式计算出10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2•2H2O的质量为多少吨?
分析 流程分析可知四氯化硅控制温度40°C,加入水水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
(1)氯化硅水解生成原硅酸和氯化氢;
(2)依据热化学方程式书写方法得到由SiCl4制备硅的热化学方程式,注意焓变的计算;
(3)pH=3.4时,三价铁离子转化为氢氧化铁,当调节PH=7时能促使三价铁离子沉淀完全;
(4)依据溶度积常数计算;
(5)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值确定滤渣A的成分;
(6)依据钡元素守恒关系计算得到.
解答 解:(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(2)用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,转移4mol电子吸收热量236KJ,反应的热化学方程式:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(3)pH=3.4时,三价铁离子完全生成沉淀,使Fe3+完全沉淀;盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2,同时使使Fe3+完全沉淀,
故答案为:使BaCO3转化为BaCl2;使Fe3+完全沉淀生成氢氧化铁沉淀;
(4)pH=7溶液中铁离子全部沉淀,c(OH-)=10-7mol/L,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.2×10-38,c(Fe3+)=$\frac{2.2×1{0}^{-38}}{(1{0}^{-7})^{3}}$=2.2×10-17mo/L;
故答案为:2.2×10-17mo/L;
(5)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成氢氧化镁,Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓;
(6)10吨含78.8% BaCO3的钡矿粉制备BaCl2•2H2O,结合钡元素守恒得到,
BaCO3 ~BaCl2•2H2O
197 244
10t×78.8% m
理论上最多能生成BaCl2•2H2O的质量m=10t×78.8%×$\frac{244}{197}$=9.76t,
答:质量为9.76t.
点评 本题考查了BaCl2•2H2O制备实验方案的设计方法,题目难度中等,为高考的热点,正确理解制备流程、反应原理为解答关键,涉及了制备方案的设计、热化学方程式、离子方程式书写,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO-3═Fe3++NO↑+2H2O | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: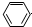 -O-+CO2+H2O→ -O-+CO2+H2O→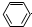 -OH+HCO3- -OH+HCO3- |
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA | |
| C. | 欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 实验室以H2O2和MnO2为原料制取O2,每生成1mol O2转移2NA个电子 |
| A. | 7.5 mL | B. | 15.0 mL | C. | 17.5 mL | D. | 35.0 mL |
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变.
| A. | ②④⑤ | B. | ①③④⑥ | C. | ①②④⑥ | D. | ①②③④⑤ |
| A. | 约3.3 | B. | 8 | C. | 6 | D. | 4 |