题目内容
14.100℃时pH=3的盐酸和pH=9的氢氧化钠溶液以体积比11:9混合,混合液的pH为( )| A. | 约3.3 | B. | 8 | C. | 6 | D. | 4 |
分析 100℃时,水的离子积为Kw=1×10-12,pH=3的盐酸中c(H+)=10-3mol/L,pH=9的氢氧化钠中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3mol/L,二者以体积比11:9混合,则盐酸过量,溶液呈酸性,先计算混合溶液中氢离子浓度,再计算溶液的pH.
解答 解:100℃时,水的离子积为Kw=1×10-12,pH=3的盐酸中c(H+)=10-3mol/L,pH=9的氢氧化钠中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3mol/L,二者以体积比11:9混合,则盐酸过量,溶液呈酸性,混合溶液中c(H+)=$\frac{1{0}^{-3}(11-9)}{11+9}$=10-4mol/L,则溶液的pH=4,
故选D.
点评 本题考查了pH的简单计算,首先判断混合溶液的酸碱性,再结合离子积常数计算出混合溶液中氢离子浓度,从而得出混合溶液的pH,题目难度中等,注意温度对Kw的影响.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
2.下列有关说法正确的是( )
| A. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 某温度下,在体积一定的密闭容器中适量的NH3气和Cl2气恰好完全反应,产物只有N2气和NH4Cl固体,则反应前后容器中的压强比接近于11:1 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | 向Fe(OH)3胶体中逐滴滴加入过量HI出现先沉淀后溶解现象,最后得到无色溶液 |
9.N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为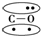 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有叁键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
 (1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥.若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积
(1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥.若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积

 ;写出X、Y之间反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2;
;写出X、Y之间反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2;