题目内容
11.下列离子方程式正确的是( )| A. | 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO-3═Fe3++NO↑+2H2O | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: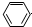 -O-+CO2+H2O→ -O-+CO2+H2O→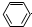 -OH+HCO3- -OH+HCO3- |
分析 A.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
B.铁粉过量,反应生成亚铁离子;
C.氯气足量,溴离子和亚铁离子都完全反应;
D.苯酚的酸性大于碳酸氢钠,苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠.
解答 解:A.少量SO2通入Ca(ClO)2溶液中,二者发生氧化还原反应,正确的离子反应为:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故A错误;
B.稀硝酸中加入过量铁粉,反应生成硝酸亚铁、一氧化氮气体和水,正确的离子方程式为:Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.溴化亚铁溶液中通入足量氯气,离子方程式按照溴化亚铁的书写,正确的离子方程式为:2Fe2++4Br-+3Cl2═4Fe3++Br2+6Cl-,故C错误;
D.苯酚钠溶液中通入少量二氧化碳,反应生成苯酚和碳酸氢钠,反应的离子方程式为: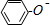 +CO2+H2O→
+CO2+H2O→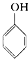 +HCO3-,故D正确;
+HCO3-,故D正确;
故选D.
点评 本题考查了离子方程式的书写方法判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,D为易错点,注意反应生成的是碳酸氢钠.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
1.同温同压下,下列气体密度最小的是( )
| A. | N2 | B. | O2 | C. | H2S | D. | H2 |
2.下列判断正确的是( )
| A. | 离子化合物中不可能含有共价键 | |
| B. | 晶体中一定存在化学键 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 直径介于1-10nm之间的微粒称为胶体 |
6.下列说法正确的是( )
| A. | 在乙醇分子间,既存在分子间作用力又存在氢键 | |
| B. | 带相反电荷离子之间的相互吸引称为离子键 | |
| C. | 同素异形体间的相互转化属于物理变化 | |
| D. | H2O比H2S稳定,因为水分子间有氢键 |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 16g甲基正离子(13CH3+)所含中子数为9NA | |
| C. | 3.0 g淀粉和葡萄糖混合物中共含碳原子数0.1NA | |
| D. | 标准状况下,1mol SO3含有的分子数为NA |
3.汽车排放的废气造成环境污染越来越受到人们的高度重视.汽车尾气无害化处理反 应为:2NO(g)+2CO(g) N2(g)+2CO2(g).在某2L的容器中充入一定量的NO和CO发生反应,下列说法正确的是( )
| A. | 使用催化剂既能加快反应速率又能提高反应物转化率 | |
| B. | 恒温恒容下充入O2,v正、v逆均不变 | |
| C. | 恒温恒容时,混合气体的平均相对分子质量和气体密度保持不变,都能标志反应达到平衡状态 | |
| D. | 当有 2molC≡O 键断裂同时有1molN≡N 键断裂,标志反应达到平衡状态 |
 (1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥.若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积
(1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥.若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积