题目内容
15.在试管中进行的Na2CO3和盐酸的反应,若最初产生的细小气泡的直径为0.1mm,其体积约为5×10-7mL,请估算该气泡中含有的CO2分子数1.23×1013.分析 气泡的体积约为5×10-7mL=5×10-10L,常温下气体摩尔体积约为24.5L/mol,根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量,再根据N=nNA计算出该气泡中含有的CO2分子数.
解答 解:常温下气体摩尔体积约为24.5L/mol,气泡的体积约为5×10-7mL=5×10-10L,
则该气泡中含有二氧化碳的物质的量为:$\frac{5×1{0}^{-10}L}{24.5L/mol}$=2.041×10-11mol,
该气泡中含有二氧化碳的分子数为:N(CO2)=6.02×1023×2.041×10-11=1.23×1013,
故答案为:1.23×1013.
点评 本题考查了气体摩尔体积的计算,题目难度中等,明确物质的量与气体摩尔体积、阿伏伽德罗常数的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
5.NA为阿伏加德罗常数的值,下列说法正确的是(填字母).( )
| A. | 标准状况下,3.36 L NO2与水充分反应转移的电子数为0.1NA | |
| B. | 12 g金刚石中含有的共价键数为4NA | |
| C. | 将22.4 L Cl2通入足量水中,反应转移的电子数为NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA |
6.下列说法正确的是( )
| A. | 在乙醇分子间,既存在分子间作用力又存在氢键 | |
| B. | 带相反电荷离子之间的相互吸引称为离子键 | |
| C. | 同素异形体间的相互转化属于物理变化 | |
| D. | H2O比H2S稳定,因为水分子间有氢键 |
3.汽车排放的废气造成环境污染越来越受到人们的高度重视.汽车尾气无害化处理反 应为:2NO(g)+2CO(g) N2(g)+2CO2(g).在某2L的容器中充入一定量的NO和CO发生反应,下列说法正确的是( )
| A. | 使用催化剂既能加快反应速率又能提高反应物转化率 | |
| B. | 恒温恒容下充入O2,v正、v逆均不变 | |
| C. | 恒温恒容时,混合气体的平均相对分子质量和气体密度保持不变,都能标志反应达到平衡状态 | |
| D. | 当有 2molC≡O 键断裂同时有1molN≡N 键断裂,标志反应达到平衡状态 |
10.下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
①Na2CO3 ②Al(OH)3 ③NH4HCO3 ④Al2O3.
①Na2CO3 ②Al(OH)3 ③NH4HCO3 ④Al2O3.
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | 全部 |
12.下列说法中不正确的是( )
| A. | 人体运动所消耗的能量与化学反应有关 | |
| B. | 煤和石油都属于化石燃料 | |
| C. | 化学反应必然伴随发生能量变化 | |
| D. | 不需要加热就能进行的反应都是放热反应 |
9.N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为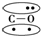 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有叁键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
10.下列有关胶体的叙述中不正确的是( )
| A. | 实验室可用丁达尔效应鉴别胶体与溶液 | |
| B. | 豆浆制豆腐是利用了胶体聚沉的原理 | |
| C. | 氢氧化铁胶体微粒带负电,通电时胶体微粒向直流动电源正极移动 | |
| D. | 配制氢氧化铁胶体时,可将饱和FeCl3溶液滴入沸水中 |
