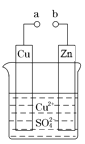
题目内容
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是( )
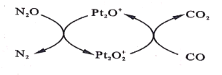
A.N2O转化成无害气体时的催化剂是![]()
B.每1molPt2O+转化为Pt2O![]() 得电子数为2NA
得电子数为2NA
C.将生成的CO2通人含大量![]() 、Na+、Cl-的溶液中,无明显现象
、Na+、Cl-的溶液中,无明显现象
D.1gCO2、N2O的混合气体中含有电子数为0.5NA
【答案】D
【解析】
A.根据转化关系,N2O转化N2时,Pt2O+转化为![]() ,则该过程的催化剂是Pt2O+,故A错误;
,则该过程的催化剂是Pt2O+,故A错误;
B.根据转化关系,结合得失电子守恒,N2O转化N2时,Pt2O+转化为![]() ,氧化还原反应方程式为:N2O+Pt2O+=N2+Pt2O2+,反应中氮元素由+1价得电子变为0价,1molN2O转化为N2得到2mol电子,则每1molPt2O+转化为
,氧化还原反应方程式为:N2O+Pt2O+=N2+Pt2O2+,反应中氮元素由+1价得电子变为0价,1molN2O转化为N2得到2mol电子,则每1molPt2O+转化为![]() 失电子为2mol,数目为2NA,故B错误;
失电子为2mol,数目为2NA,故B错误;
C.将生成的CO2通入含大量![]() 、Na+、Cl-的溶液中,碳酸的酸性大于硅酸,
、Na+、Cl-的溶液中,碳酸的酸性大于硅酸,![]() +CO2(少量)+H2O=
+CO2(少量)+H2O=![]() +H2SiO3↓,有白色沉淀生成,故C错误;
+H2SiO3↓,有白色沉淀生成,故C错误;
D.CO2和N2O的摩尔质量都为44g/mol,一个分子中含有的电子数都为22个,则1gCO2、N2O的混合气体的物质的量为![]() mol,含有电子数为
mol,含有电子数为![]() ,故D正确。
,故D正确。
故答案选D。

【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
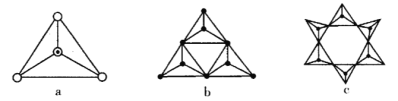
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。