题目内容
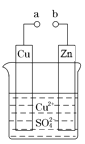
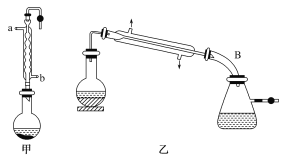
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)图甲中冷凝水从__(填“a”或“b”)进,图乙中B装置名称__。
(2)反应中加入过量的乙醇,目的是__。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:

则试剂a是__,分离方法Ⅰ是__,试剂b是__(填序号)。
A.浓盐酸 B.浓硫酸 C.浓硝酸
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果为:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:
①甲实验失败的原因是:___。
②乙实验失败的原因是:__。
【答案】b 尾接管 提高乙酸的转化率 饱和Na2CO3溶液 分液 B 所加NaOH溶液不足,未将酸完全反应 所加NaOH溶液过量,酯发生水解
【解析】
本题主要考查乙酸乙酯的实验室制备的装置、除杂、分离,饱和碳酸钠溶液的作用,乙酸乙酯的水解条件的选择,只要将课本中的知识点掌握到位,就没有什么难度。
(1)冷凝管中的冷凝水是下进上出,即图甲中冷凝水从b进,从图乙中可知B装置名称是尾接管;
(2)由于制备乙酸乙酯的反应是可逆反应,加入过量的乙醇,目的是使平衡向着生成乙酸乙酯的方向移动,提高乙酸的转化率;
(3)由于试剂a要能够除去乙酸乙酯中的乙酸和乙醇等杂质,又尽量不减少乙酸乙酯的量,故可以用饱和碳酸钠溶液;方法Ⅰ分离后得到油层A和水层B,故进行的是互不相溶的液体,故用分液方法;水层B中主要含有乙醇和乙酸钠溶液,加入试剂b的目的是将乙酸钠转化为乙酸,由于浓盐酸、浓硝酸有挥发性,故选用浓硫酸;
(4)①甲得到了显酸性的酯的混合物,说明原来的乙酸并没有完全中和,甲实验失败的原因是加入的NaOH不足,酸未完全反应;
②乙酸乙酯是难溶于水的油状液体,乙得到了大量水溶性的物质,说明乙酸乙酯在碱性条件下完全水解成了易溶于水的乙醇和乙酸钠,乙实验失败的原因是加入的NaOH溶液太多了,是乙酸乙酯完全水解了。

【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
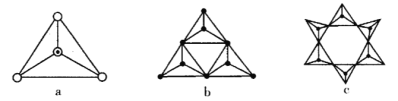
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。