题目内容
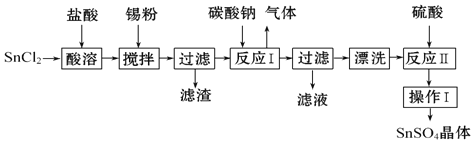
【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:

(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线
【答案】增大接触面积,加快浸取反应速率,提高原料的浸取率 ![]() 氧化剂
氧化剂 ![]() 或
或![]() 或
或![]()
![]() 溶液
溶液 ![]()
![]()
![]() BC
BC
【解析】
低品位铜矿![]() 主要含有
主要含有 ![]() 、CuS、FeO、
、CuS、FeO、![]() 、
、 ![]() 等
等![]() 为原料,加入稀硫酸溶液和二氧化锰,溶解后过滤得到滤液中含
为原料,加入稀硫酸溶液和二氧化锰,溶解后过滤得到滤液中含![]() 、
、![]() 、
、![]() ,滤渣为二氧化硅和生成的单质S,滤液中加入氨水调节溶液pH沉淀铁离子,过滤得到滤液Ⅱ含
,滤渣为二氧化硅和生成的单质S,滤液中加入氨水调节溶液pH沉淀铁离子,过滤得到滤液Ⅱ含![]() 、
、![]() 、
、![]() ,滤渣Ⅱ为
,滤渣Ⅱ为![]() ,滤液Ⅱ中加入氨气和碳酸氢钠生成碳酸锰沉淀和
,滤液Ⅱ中加入氨气和碳酸氢钠生成碳酸锰沉淀和![]() ,加入盐酸和铜生成CuCl。
,加入盐酸和铜生成CuCl。
![]() 将铜矿粉碎,可增大接触面积,提高浸取反应速率和原料的浸取率,故答案为:增大接触面积,加快浸取反应速率,提高原料的浸取率;
将铜矿粉碎,可增大接触面积,提高浸取反应速率和原料的浸取率,故答案为:增大接触面积,加快浸取反应速率,提高原料的浸取率;
![]() 滤渣Ⅰ的成分除S之外还有不与酸反应的二氧化硅,化学式为:
滤渣Ⅰ的成分除S之外还有不与酸反应的二氧化硅,化学式为:![]() ,反应Ⅰ中
,反应Ⅰ中![]() 的化合价
的化合价![]() 价变化为
价变化为![]() 价,化合价降低,作用是氧化剂;
价,化合价降低,作用是氧化剂;
故答案为:![]() ;氧化剂;
;氧化剂;
![]() 反应Ⅱ中用氨水调节pH值是沉淀铁离子,锰离子和铜离子不沉淀,则依据图表数据分析判断pH的取值范围为
反应Ⅱ中用氨水调节pH值是沉淀铁离子,锰离子和铜离子不沉淀,则依据图表数据分析判断pH的取值范围为![]() ;
;
故答案为:![]() 或
或![]() 或
或![]() ;
;
![]() 遇KSCN溶液呈现血红色,所以可以用KSCN溶液检验滤液Ⅱ中是否含有
遇KSCN溶液呈现血红色,所以可以用KSCN溶液检验滤液Ⅱ中是否含有![]() ,故答案为:KSCN溶液;
,故答案为:KSCN溶液;
![]() 反应Ⅲ中生成难溶
反应Ⅲ中生成难溶![]() 的离子方程式为:
的离子方程式为:
![]() ;
;
故答案为:![]() ;
;
![]() 反应Ⅳ所对应的反应是
反应Ⅳ所对应的反应是![]() 、HCl、Cu反应生成氯化亚铜、氯化铵、二氧化碳和水,反应的化学方程式为:
、HCl、Cu反应生成氯化亚铜、氯化铵、二氧化碳和水,反应的化学方程式为:
![]() ;
;
故答案为:![]() ;
;
![]() ,标准溶液体积中2实验读取误差太大舍去,平均消耗溶液体积
,标准溶液体积中2实验读取误差太大舍去,平均消耗溶液体积![]() ,称取
,称取![]() 样品和
样品和![]() 的过量
的过量![]() 溶液置于250mL锥形瓶中,不断摇动;待样品溶解后,平均分为3份,用
溶液置于250mL锥形瓶中,不断摇动;待样品溶解后,平均分为3份,用![]() 标准溶液进行滴定,则
标准溶液进行滴定,则![]() ,
,
得到对应关系![]() ,
,![]() ,则结合
,则结合![]() 得到CuCl物质的量
得到CuCl物质的量![]() ,样品中CuCl纯度
,样品中CuCl纯度![]() ;
;
依据c(待测) 分析,
分析,
A.锥形瓶中有少量蒸馏水对滴定实验无影响,故A错误;
B.滴定终点读数时仰视滴定管刻度线,其他操作正确,读取标准溶液体积增大,测定结果偏高,故B正确;
C.![]() 溶液久置后浓度变小,滴定时消耗溶液体积增大,结果偏高,故C正确;
溶液久置后浓度变小,滴定时消耗溶液体积增大,结果偏高,故C正确;
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡,读取标准溶液体积减小,测定结果偏低,故D错误;
E.用量筒取![]() 的
的![]() 溶液时仰视刻度线,则所取
溶液时仰视刻度线,则所取![]() 溶液偏大,但
溶液偏大,但![]() 本身就过量,所以对测定结果无影响,故E错误;
本身就过量,所以对测定结果无影响,故E错误;
故答案为:![]() ;BC。
;BC。

 阅读快车系列答案
阅读快车系列答案【题目】高纯碳酸锰(MnCO3)广泛应用于电子行业,制造高性能磁性材料。工业利用含锰废水(主要含Mn2+、![]() 、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:

已知某些物质完全沉淀的pH值如表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)试剂X是___________ (填标号)。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)“滤渣1”中主要成分的化学式为__________。
(3)“除重金属”时发生反应的离子方程式是______;反应中使用(NH4)2S而不使用Na2S的原因是________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_____,反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4,加入稍过量的NH4HCO3的目的是______使MnCO3沉淀完全,溶液的pH不能过低的原因是_____。
(5)由 MnCO3可制得重要的催化剂MnO2,2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0g的MnCO3,得到332.0g产品,若产品中杂质只有MnO,则该产品MnO2的质量分数是___________。
【题目】![]() 氯丙酸
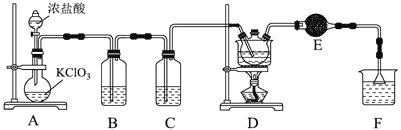
氯丙酸![]() 主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备
主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备![]() 氯丙酸的装置。
氯丙酸的装置。
已知:相关物质的物理性质如下表所示:
物质 | 熔点 | 沸点 | 溶解性 |
| 14 | 190 | 能与水、乙醇互溶 |
丙酸 |
| 141 | 能与水、乙醇互溶 |
|
|
| 与水剧烈反应,能溶于乙醇 |
制备方法:在三颈烧瓶中放置![]() 丙酸和
丙酸和![]() 三氯化磷
三氯化磷![]() 作催化剂
作催化剂![]() ,加热至
,加热至![]() ,缓慢通入氯气,保持温度在
,缓慢通入氯气,保持温度在![]() 之间大约反应
之间大约反应![]() 。
。
回答下列问题:
![]() 装置中反应的离子方程式为_____________________________________________,当生成
装置中反应的离子方程式为_____________________________________________,当生成![]() (标准状况)时,转移电子的数目为________________。
(标准状况)时,转移电子的数目为________________。
![]() 某同学分析发现D装置有两处缺陷,分别是_____________、________________。
某同学分析发现D装置有两处缺陷,分别是_____________、________________。
![]() 设计实验提纯产品:_________________________________________________________。
设计实验提纯产品:_________________________________________________________。
![]() 测定产品纯度。
测定产品纯度。
步骤Ⅰ:称取1.20g样品![]() 杂质不含
杂质不含![]() 于烧瓶中,加入
于烧瓶中,加入![]() 氢氧化钠溶液共热,冷却至室温。加入
氢氧化钠溶液共热,冷却至室温。加入![]() 硝酸,一段时间后,将烧瓶中的溶液全部转移至
硝酸,一段时间后,将烧瓶中的溶液全部转移至![]() 容量瓶中,加水定容
容量瓶中,加水定容![]() 溶液中为乳酸和
溶液中为乳酸和![]() 。
。
步骤Ⅱ:从容量瓶中各取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 作指示剂,用
作指示剂,用![]() 溶液分别滴定溶液中的
溶液分别滴定溶液中的![]() 已知:
已知:![]() 为砖红色沉淀、乳酸银不沉淀
为砖红色沉淀、乳酸银不沉淀![]() ,平行三次实验,所得滴定数据如表所示:
,平行三次实验,所得滴定数据如表所示:
实验序号 实验数据 | 第一次 | 第二次 | 第三次 | |
| 滴定前 | 0 |
|
|
滴定后 |
|
|
| |
![]() 加入硝酸的目的是_______________________________________。
加入硝酸的目的是_______________________________________。
![]() 步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
![]() 样品中
样品中![]() 氯丙酸的质量分数为__________
氯丙酸的质量分数为__________![]() 保留三位有效数字
保留三位有效数字![]() 。
。