题目内容
10.选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应).试根据实验回答:(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
分析 (1)根据实验操作过程选取实验仪器;
(2)定时边滴边摇动锥形瓶,两眼注视锥形瓶中颜色变化;
(3)达到滴定终点时溶液颜色变化且半分钟内不变色;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算,V(标准)用两次的平均值;根据m=CVM计算250mL溶液中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差.
解答 解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器是:250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶;胶头滴管;
(2)定时边滴边摇动锥形瓶,两眼注视锥形瓶中颜色变化,以防止滴定时标准溶液滴加过量,
故答案为:锥形瓶内溶液的颜色变化;
(3)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,即当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不变色;
故答案为:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不变色;
(4)V(标准)=$\frac{(20.40-0.50)+(24.10-4.00)}{2}$=20.00mL,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.2000×0.0200}{0.0100}$=0.400mol•L-1,
m=CVM=0.400mol•L-1×0.25L×40g/mol=4.0g,ω(烧碱)=$\frac{4.0g}{5.0g}$×100%=80%,
故答案为:80%;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知:
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,测定c(NaOH)偏大,故A不符合;
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定,则锥形瓶中氢氧化钠的物质的量偏大,所以消耗的HCl的体积偏大,即V(标准)偏大,测定c(NaOH)偏大,故B不符合;
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,待测液的物质的量不变,对V(标准)无影响,测定c(NaOH)无影响,故C不符合;
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面,待测液的物质的量减小,消耗的标准溶液的物质的量偏少,则V(标准)偏小,所以测定c(NaOH)偏低,故D符合;
故答案为:D.
点评 本题主要考查了中和滴定操作、误差分析以及烧碱的纯度的计算,难度中等,注意知识的积累,侧重于考查学生的实验能力和计算能力.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 1mol石墨比1mol金刚石的总能量低 | D. | 1mol石墨比1mol金刚石的总能量高 |
①NH3 ②NH3•H2O ③H2O ④OH- ⑤NH${\;}_{4}^{+}$ ⑥H+.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
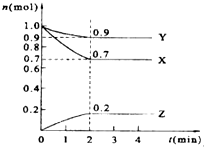 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.




