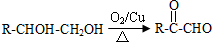题目内容
20.下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
(1)①的元素符号是N;
(2)②、⑥两种元素的原子半径大小关系 ②<⑥(填“<”或“>”);
(3)③、⑤两种元素的金属性强弱关系 ③>⑤(填“<”或“>”);
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液反应的离子方程式:Mg+2H+=Mg2++H2↑.
分析 由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)①为N元素;
(2)同主族元素从上到下原子半径逐渐增大;
(3)同周期元素从左到右金属性逐渐减弱;
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液的反应为镁和稀硫酸的反应.
解答 解:由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)由元素在周期表中的位置可知①为N元素,故答案为:N;
(2)同主族元素从上到下原子半径逐渐增大,原子半径S>O,故答案为:<;
(3)同周期元素从左到右金属性逐渐减弱,则金属性Na>Mg,故答案为:>;
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液的反应为镁和稀硫酸的反应,反应的离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置分析元素为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应).试根据实验回答:
(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)根据上述数据计算,烧碱样品的纯度为80%.
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
11. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③如图,排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有BD.(多选扣分)
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.锥形瓶水洗后用待测稀盐酸溶液润洗
E.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③如图,排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有BD.(多选扣分)
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.锥形瓶水洗后用待测稀盐酸溶液润洗
E.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗.
8.下列离子方程式正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
15.分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
12.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( ) 

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 可与NaOH反应但是不与Na2CO3发生反应 | |
| C. | 1mol该有机物不可以Br2发生取代反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
9.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入CCl4溶液,充分振荡静置后,分液 | |
| D. | 苯中混有苯酚,加入氢氧化钠溶液,再用分液漏斗分液 |
10.R、W、X、Y、Z是同一短周期主族元素,原子序数依次递增.下列说法一定正确的是(m,n均为整数)( )
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若Y的最低负化合价为-2,则Z的最高正化合价为+6 | |
| C. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| D. | 若X的最高正化合价为+5,则五种元素一定都是非金属元素 |
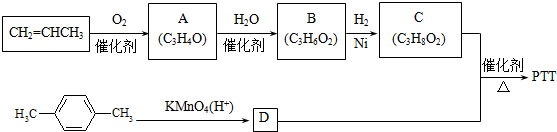
 .
.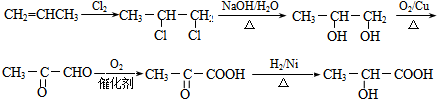 .
.