题目内容
9.氨水中存在的粒子有( )①NH3 ②NH3•H2O ③H2O ④OH- ⑤NH${\;}_{4}^{+}$ ⑥H+.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
分析 在氨水中存在下列平衡,NH3+H2O?NH3•H2O,NH3•H2O?NH4++OH-,H2O?H++OH-,据此分析氨水中含有离子种类.
解答 解:在氨水中存在下列平衡,NH3+H2O?NH3•H2O,NH3•H2O?NH4++OH-,H2O?H++OH-,所以氨水中存在的分子有①NH3 ②NH3•H2O ③H2O,
存在的离子有④OH- ⑤NH4+ ⑥H+.
故选D.
点评 本题考查氨水成分,题目难度不大,本题注意把握氨气与水反应的性质以及水的电离.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见上表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
17.下列关于实验室制取氯气的操作正确( )
①用药匙向烧瓶中加入浓盐酸,再向分液漏斗中装入MnO2粉末;②用酒精灯直接加热烧瓶;
③需检查装置的气密性;④多余氯气用NaOH溶液吸收;⑤可用装有碱石灰的干燥管干燥氯气.
①用药匙向烧瓶中加入浓盐酸,再向分液漏斗中装入MnO2粉末;②用酒精灯直接加热烧瓶;
③需检查装置的气密性;④多余氯气用NaOH溶液吸收;⑤可用装有碱石灰的干燥管干燥氯气.
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
4.在下列元素中,不属于主族元素的是( )
| A. | 铁 | B. | 钙 | C. | 氧 | D. | 溴 |
3.某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题.
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为CuSO4、Cu(NO3)2,剩余固体总质量为2.24 g
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
| 实验示意图 | 实验现象 | 解释 |
甲: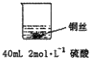 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
10.选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应).试根据实验回答:
(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)根据上述数据计算,烧碱样品的纯度为80%.
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
8.下列离子方程式正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.