题目内容
12.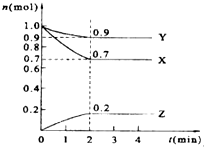 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)Y的转化率是10%.
(2)由图中所给数据进行分析,该反应的化学方程为3X+Y?2Z;
(3)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为0.00125mol/(L•s).
(4)当反应进行到第2min,该反应达到平衡.
分析 (1)根据转化率=$\frac{转化量}{起始量}$×100%计算;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据v=$\frac{△c}{△t}$计算反应速率;
(4)根据平衡时各组分的物质的量不变这一特征作判断.
解答 解:(1)根据转化率=$\frac{转化量}{起始量}$×100%=$\frac{(1-0.9)mol}{1mol}$×100%=10%,故答案为:10%;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)v(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol•(L•min)-1=0.00125mol/(L•s),故答案为:0.00125mol/(L•s);
(4)根据图象可知,当在2mim时,反应中各组份的物质的量不再随时间变化而变化,此时反应达到平衡状态,故答案为:2.
点评 本题考查化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法及基本公式的应用.

练习册系列答案
相关题目
2.化学与环境、生产和生活等密切相关,下列说法正确的是( )
| A. | pH小于7的雨水即为酸雨 | |
| B. | 用食醋可除去水壶内壁上的水垢 | |
| C. | 为了除去MgCl2酸性溶液的Fe3+,可在加热搅拌的条件下加入氨水 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
17.下列关于实验室制取氯气的操作正确( )
①用药匙向烧瓶中加入浓盐酸,再向分液漏斗中装入MnO2粉末;②用酒精灯直接加热烧瓶;
③需检查装置的气密性;④多余氯气用NaOH溶液吸收;⑤可用装有碱石灰的干燥管干燥氯气.
①用药匙向烧瓶中加入浓盐酸,再向分液漏斗中装入MnO2粉末;②用酒精灯直接加热烧瓶;
③需检查装置的气密性;④多余氯气用NaOH溶液吸收;⑤可用装有碱石灰的干燥管干燥氯气.
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
4.在下列元素中,不属于主族元素的是( )
| A. | 铁 | B. | 钙 | C. | 氧 | D. | 溴 |
10.选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应).试根据实验回答:
(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)根据上述数据计算,烧碱样品的纯度为80%.
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
(1)准确称取5.0g烧碱样品,将已称好的样品配成250mL待测液,需要的仪器除了烧杯,玻璃棒还有250mL容量瓶、胶头滴管.
(2)取10ml待测液于锥形瓶中,用0.2mol/L的标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视锥形瓶内溶液的盐酸变化,直到滴定终点.
(3)判断到达滴定终点的实验现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(5)下列操作会使实验结果偏低的是D
A.用蒸馏水洗净酸式滴定管后,即装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水,最后用标准盐酸进行滴定
D.滴定过程中振荡锥形瓶时,有少量溶液洒在锥形瓶外面.
11. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③如图,排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有BD.(多选扣分)
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.锥形瓶水洗后用待测稀盐酸溶液润洗
E.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③如图,排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有BD.(多选扣分)
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.锥形瓶水洗后用待测稀盐酸溶液润洗
E.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗.
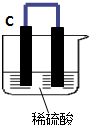 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.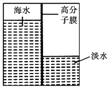 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.