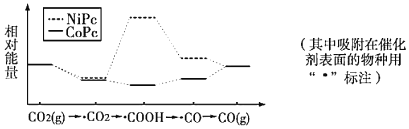
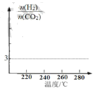
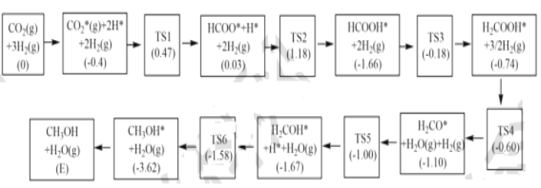
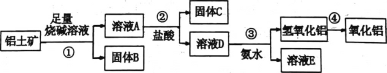
题目内容
【题目】由氧化铜、氧化铁、氧化锌组成的混合物ag,加入2mol/L硫酸50mL时固体恰好完全溶解,若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后剩余固体的质量为
A.1.6gB.(a-1.6)gC.(a-3.2)gD.无法确定
【答案】B
【解析】
铁铜和锌的氧化物在足量的CO中加热,最终得到的固体是相应元素的单质,所以要求固体的质量,若能求出氧化物混合物中氧元素的总质量,在氧化物总质量的基础上扣除即可。上述混合物与硫酸反应过程不涉及变价,实质是复分解反应,可以简单表示为:![]() ,其中x不一定为整数。因此,消耗的H+的量是金属氧化物中O的两倍,所以该金属氧化物的混合物中:
,其中x不一定为整数。因此,消耗的H+的量是金属氧化物中O的两倍,所以该金属氧化物的混合物中:![]() ,所以金属元素总质量为(a-1.6)g,B项正确;
,所以金属元素总质量为(a-1.6)g,B项正确;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】氧化还原反应在日常生活中有着广泛的应用,下列有关化学用语和相关说法均正确的是
选项 | 化学反应方程式 | 相关说法 |
A |
| 氧气是氧化产物,氯酸钾既是氧化剂又是还原剂 |
B | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
C | 4CuO | 该反应中每生成1molO2,则转移2NA个电子 |
D | 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ | 氧化性:Na2O2>Na2FeO4>FeSO4 |
A.AB.BC.CD.D